Translacijska istraživanja
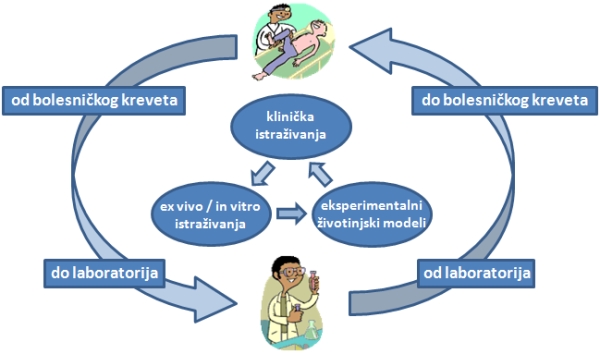
Koncept translacijskih istraživanja počeo se stvarati prije desetak godina, početkom ovog stoljeća, kada je prepoznata nedovoljna povezanost temeljnih istraživanja, kliničkih istraživanja i svakodnevne medicinske prakse te nedovoljna razmjena znanja između sudionika ovih procesa. Cilj translacijskih istraživanja jest integracija otkrića koja potječu iz temeljnih, kliničkih ili populacijskih istraživanja u kliničku primjenu kako bi se unaprijedilo ljudsko zdravlje i poboljšala zdravstvena skrb, ali i poboljšao prijenos znanja u suprotnom smjeru, iz kliničke prakse u istraživanje. Translacijska istraživanja temelj su translacijske medicine. Nju provode liječnici koji su u stanju povezati rezultate temeljnih znanstvenih istraživanja i novonastale inovacije s kliničkim istraživanjima i translatirati rezultate kliničkih pokusa u promjenu kliničke prakse u sve to uključujući podatke iz područja socijalnih i političkih znanosti. Tako se translacijska medicina najčešće definira kao istraživanje koje dvosmjerno povezuje laboratorij i bolesnički krevet (engl. “from bench to bedside”) odnosno omogućuje da temeljno istraživanje postane primjenjivo u dijagnostici, liječenju, ali i prevenciji bolesti kroz proces pretvaranja znanstvenih izuma u nove lijekove, metode liječenja i medicinske instrumente. Stoga je nužna suradnja između temeljnih i kliničkih istraživačkih timova te je translacijska medicina u svijetu usko vezana uz akademsku medicinu.
Translacijska su istraživanja u manjem obimu, premda nejasno definirana i regulirana, postojala i u prošlosti i imala stanoviti utjecaj na poimanje i ishod bolesti. Posebice je to bio slučaj u studijama primjene novih lijekova, inovacijama u tehnologiji i biomedicinskoj opremi te epidemiološkim istraživanjima koja se mogu translatirati na bolesnički krevet ili u polikliniku. No, sustavni pristup razvoju translacijskih istraživanja i translacijske medicine primjetan je tek u zadnjih desetak godina.
Značajnu ulogu u razvoju translacijskih istraživanja odigrali su tekstovi koje je od 2003. godine pa tijekom proteklog desetljeća objavljivao tadašnji direktor Nacionalnih instituta za zdravstvo (engl. National Institutes of Health, NIH) Sjedinjenih Američkih Država prof. dr. sc. Elias Zerhouni, a u kojima je isticao odgovornost svih uključenih u biomedicinska istraživanja za prijenos nastalih inovacija u dobitak za zdravlje nacije.
Istovremeno s ovim zbivanjima u Sjedinjenim Američkim Državama i u Europi raste potreba za razvojem translacijskih istraživanja u sklopu najuglednijih akademskih institucija. Istraživački fakulteti u Njemačkoj, Velikoj Britaniji, Španjolskoj i skandinavskim zemljama deklariraju svoju orijentaciju prema translacijskim istraživanjima i translacijskoj medicini. Prepoznaje se potreba za umrežavanjem i suradnjom između akademskih ustanova koje grade translacijska istraživanja te se pokreće veliki europski projekt EATRIS (European Advanced Translational Research Infrastructure in Medicine).
Ubrzo nakon Sjedinjenih Američkih Država i Europe i zagrebački Medicinski fakultet 2007. godine, kao prvi u Hrvatskoj, prepoznaje potrebu za utemeljenjem translacijske medicine te 2009. godine osniva Centar za translacijska i klinička istraživanja Medicinskog fakulteta i Kliničkog bolničkog centra Zagreb.
Ustrojstvo
CENTAR ZA TRANSLACIJSKA I KLINIČKA ISTRAŽIVANJA
Uprava
Savjet Centra
Odjeli, laboratoriji i ured
- Ured za znanost i transfer tehnologije
- Laboratorij za mineralizirana tkiva
- Odjel za funkcionalnu genomiku
- Odjel za istraživanje reprodukcije i razvoja
- Odjel za međustaničnu komunikaciju
- Odjel za proteomiku
Ured za prijenos znanja i inovacije
O uredu
Ured za prijenos znanja i inovacije, kao dio Centra za translacijska i klinička istraživanja (CETKI) pruža stručnu potporu temeljnim, translacijskim i kliničkim istraživanjima koja na Medicinskom fakultetu Sveučilišta u Zagrebu i na KBC-u Zagreb provode njihovi djelatnici i studenti.
Ured pruža podršku znanstvenicima pri pisanju i provedbi istraživačkih projekata te pomaže u području korištenja intelektualnog vlasništva, njegove zaštite i prijenosa znanja i tehnologija kako u komercijalne tako i u druge društveno važne i korisne svrhe. Glavni cilj Ureda je iznalaženje najboljeg i najbržeg načina da rezultati istraživanja dođu do krajnjih korisnika – pacijenata.
Svojim iskustvom u provedbi kliničkih istraživanja Ured predstavlja jedinstveno mjesto potpore zaposlenicima Medicinskog fakulteta koji rade na klinikama te provode visoko regulirana istraživanja koja uključuju bolesnike.
Ured provodi sljedeće aktivnosti i usluge:
Zaštita intelektualnog vlasništva i transfer tehnologije:
- Podučava znanstvenike i studente u području intelektualnog vlasništva i prijenosa tehnologije
- Potiče zaštitu intelektualnog vlasništva i njegovog korištenja
- Pruža podršku istraživačima u prepoznavanju i zaštiti intelektualnog vlasništva
- Sam ili u suradnji sa Sveučilišnim Uredom za transfer tehnologije te drugim vanjskim stručnjacima provodi evaluacije i procjenjuje komercijalni potencijal izuma i ostalih rezultata znanstvenih istraživanja
- Priprema i provjerava ugovore o čuvanju tajnosti i prijenosu materijala.
- Organizira i koordinira suradnju s industrijom, pregovara i priprema nacrte sporazuma ili pregledava i odobrava, uz pomoć pravne službe, ugovore s industrijom. Uspostavlja suradnju s tvrtkama koje posreduju između znanstvenika i industrije.
- Priprema nacrte licenčnih ugovora, ugovora o prijenosu prava vlasništva i ostale ugovore vezane za intelektualno vlasništvo i njegov prijenos.
- Sudjeluje i pomaže u osnivanju spin-off kompanija Fakulteta u suradnji s pravnom službom i vanjskim stručnjacima u području te pregovara o vlasničkim udjelima u novonastalim tvrtkama.
- Vodi evidenciju o intelektualnom vlasništvu fakulteta, patentima, licenčnim ugovorima i ostalim oblicima zaštićenog i nezaštićenog intelektualnog vlasništva, ugovorima o komercijalizaciji i ne-komercijalnim oblicima korištenja rezultata intelektualnog vlasništva
- U okruženju kompleksnih odnosa kod zajedničkih istraživanja pomaže oko provjere ugovora o suradnji (s jednim ili više partnera), ugovorima o kliničkim istraživanjima i ostalim sporazumima koji u sebi sadrže klauzule o pravima intelektualnog vlasništva, prava na pristup informacijama (en. access rights) i drugim rezultatima i pravima povezanim s prijenosom znanja ili tehnologija.
Priprema projektnih prijedloga i provedba projekata:
- Pruža podršku u pripremi međunarodnih projektnih prijava, osobito u dijelu koji se odnosi na prijenos znanja te korištenje i održivost rezultata istraživanja.
- Sudjeluje u provedbi projekata u dijelu koji se odnosi na korištenje rezultata („Exploitation of results“).
- Sudjeluje u provedbi projekata za jačanje kapaciteta institucije i jačanju aktivnosti prijenosa znanja i tehnologija u području zdravlja i biomedicine
- Pomaže u upravljanju projektima i educira nove djelatnike
Ostale aktivnosti:
- Sudjeluje u radu Povjerenstva za upravljanje intelektualnim vlasništvom i daje stručna mišljenja o prijavljenim izumima.
- Surađuje s Centrom za istraživanje, razvoj i transfer tehnologije Sveučilišta u Zagrebu i sudjeluje u zajedničkim aktivnostima
- Sudjeluje u radu ASTP (Europe’s association of Knowledge Transfer professionals)
- Sudjeluje u radu EATRIS ERIC, europske istraživačke infrastrukture
Djelatnici
Lozika Mašić
E-mail: lozika.masic@mef.hr
Odjel za međustaničnu komunikaciju
O odjelu
Odjel za međustaničnu komunikaciju osnovan je kao ogranak farmaceutske industrije unutar akademske zajednice radi poticanja bliske suradnje tih komplementarnih, ali često nedovoljno integriranih istraživačkih djelatnosti. U tom je smislu GlaxoSmithKline (GSK) istraživački centar Zagreb, s ciljem poticanja translacijskih istraživanja u području otkrivanja novih lijekova, zajedno s Medicinskim fakultetom uložio sredstva u adaptaciju prostora i opremanje Odjela te stavio na raspolaganje educirano i iskusno osoblje suosnivačima Centra.
Osnovna djelatnost i trenutačni interes Odjela izučavanje je suživota, međudjelovanja i uzajamne regulacije različitih mikrobijalnih zajednica (mikrobiota) i domaćina, s ciljem širenja znanja o ulozi ovih procesa u održavanju ljudskog zdravlja, kao i u patogenezi infektivnih i upalnih bolesti. Prikupljena znanja nužno je integrirati u kliničku praksu, u svrhu poboljšanja dijagnostike u infektivnim i upalnim bolestima kao i doprinosa efikasnijim strategijama liječenja i razvoja učinkovitijih ciljanih lijekova. Stoga je razumijevanje suptilnih interakcija koje reguliraju suživot mikroorganizama i domaćina ili dovode do progresije u patogena stanja glavni znanstveni interes djelatnika Odjela.
Znanstvenici Odjela imaju dugogodišnje radno iskustvo u farmaceutskoj industriji (PLIVA Istraživački institut, a potom GlaxoSmithKline Istraživački centar) u sklopu brojnih projekata istraživanja i razvoja novih lijekova. Riječ je o istraživačima s opsežnom ekspertizom u području molekularne biologije, stanične biologije, mikrobiologije i razvoja novih istraživačkih metoda. Djelatnici Odjela posjeduju i znanja vezana uz širi kontekst razvoja novih lijekova, otkrivanje novih bioloških meta, zaštitu intelektualnog vlasništva i vođenje znanstvenih projekata. Stečena znanja i prikupljeno iskustvo djelatnici odjela koriste za razvoj potencijalnih novih terapija te kliničkih strategija i intervencija i time doprinose razvoju kliničke i translacijske medicine.
Odjel ostvaruje niz suradnji s relevantnim znanstvenim ustanovama i istraživačkim grupama u zemlji i inozemstvu. Djelatnici Odjela redovito aktivno sudjeluju kao stručni evaluatori projekata prijavljenih na EU, međunarodne i domaće natječaje u području znanosti, inovacija i gospodarstva.
Znanstveni projekti
- MINUTE for IBD (HRZZ)
- PROBITECT (IRI)
- MaCrovid (Zaklada Adris)
- OSTEOGROW (FP7)
- OSTEOproSPINE (Horizon 2020)
- Znanstveni Centar Izvrsnosti za Reproduktivnu i Regenerativnu Medicinu
- Projekt razvoja karijera mladih istraživača (HRZZ)
- ADRIROSA (IRI)
Voditelj
Dr. sc. Mihaela Perić, viša znanstvena suradnica
Djelatnici
Dr. sc. Hana Čipčić Paljetak, znanstvena suradnica
Dr. sc. Mario Matijašić, znanstveni suradnik
Dora Hrestak, mag. ing. bioproc., doktorand
Odjel za funkcionalnu genomiku
O odjelu
Odjel za funkcionalnu genomiku osnovan je 2003. godine od strane Medicinskog fakulteta Sveučilišta u Zagrebu, Kliničkog bolničkog centra Zagreb te znanstvenika Harvard Medical School iz SAD kao znanstveni centar namijenjen poticanju translacijskih istraživanja korištenjem naprednih genomskih tehnologija (tada pod imenom Centar za funkcionalnu genomiku). Kao prvi takav centar u području Jugoistočne Europe, Centar za funkcionalnu genomiku postavio je svojim radom temelje za nastanak i pokretanje Centra za translacijska i klinička istraživanja. Kada je 2009. godine osnovan Centar za translacijska i klinička istraživanja Centar za funkcionalnu genomiku je preimenovan u Odjel za funkcionalnu genomiku. Od samog početka djelovanja Odjela velika važnost pridavana je razvijanju međunarodne suradnje, što je rezultiralo zajedničkim projektima i programima sa znanstvenicima s Harvard University i New York University iz SAD-a, kao i s brojnim znanstvenim institucijama iz Europe, poput Institute for Molecular Medicine (Portugal), Medical Research Council Human Genetics Unit (Velika Britanija), University College Dublin (Irska) ili Ludwig-Maximilians Universität München (Njemačka).
Znanstvena djelatnost unutar Odjela usmjerena je k povezivanju temeljnih i kliničkih znanstvenika u modernim genomskim istraživanjima, a u svrhu promicanja translacijskih pristupa. Tijekom godina, u sklopu Odjela provedena su brojna istraživanja, od istraživanja genske ekspresije u životinjskim modelima osteoporoze, preko molekularnih osnova kognitivnih poremećaja, potrage za novim biomarkerima za neurodegenerativne bolesti do istraživanja molekularnih osnova hematoloških i autoimunih bolesti.
Projekti koji su se do sada provodili na Odjelu za funkcionalnu genomiku financirali su Europska Unija, Svjetska banka, Ministarstvo znanosti, obrazovanja i športa RH, Hrvatska zaklada za znanost, Michael J. Fox fondacija, Parkinson’s UK fondacija, ADRIS fondacija, DAAD i HAMAG/BICRO. Znanstvena djelatnosti Odjela dovela je i do kliničke primjene novih genomskih dijagnostičkih testova u praksu. Uz veliki napor djelatnika, na listu DTP-ova (koju pokriva HZZO) uvršteni su genomski dijagnostički testovi:
- panel gena za epilepsiju (oznaka DTP-a LG206),
- komparativna genomska hibridizacija na genskim čipovima (LG207 i LG 208)
- sekvenciranje kliničkog egzoma (LG235)
Znanstvenici zaposleni na Odjelu osigurali su značajna sredstva za istraživački rad putem znanstvenih projekata, kako iz domaćih izvora financiranja (npr. MZOŠ projekt “Genomska analiza transkriptoma i interaktoma u bolesnika s kompleksnim bolestima”), tako i iz sredstava Europske unije, putem Framework Programme 7 sheme. Projekt Europske unije pod naslovom “Integrating and Strengthening Genomic Research in South-Eastern Europe – INTEGERS” prvi je FP7 projekt u Republici Hrvatskoj i prvi FP projekt općenito na Medicinskom fakultetu Sveučilišta u Zagrebu čiji je koordinator iz Republike Hrvatske. Dodijeljena sredstva osigurala su da Odjel postane najbolje opremljeni centar za genomske tehnologije u regiji Jugoistočne Europe.
Voditelj
prof. dr. sc. Fran Borovečki
Djelatnici
doc. dr. sc. Antonela Blažeković
dr. sc. Kristina Gotovac Jerčić
Josipa Mateševac, mag. biol. mol
Filip Josip Bingula, bacc. med. lab. diag., tehničar
Sarah Meglaj, mag. biol. exp., doktorand
Tamara Ćutić, mag. mol. biol. exp.
Odjel za istraživanje reprodukcije i razvoja
O odjelu
Odjel za istraživanje reprodukcije i razvoja počeo je s aktivnostima 2009. godine, a njegova znanstveno-istraživačka djelatnost proizašla je iz kolaborativnog projekta MZOS-a koji je tada objedinjavao devet pojedinačnih znanstveno-istraživačkih projekata. U skladu s akcijskim planom Medicinskog fakulteta, a prema Istraživačkoj strategiji Sveučilišta u Zagrebu, načinjen je prijedlog translacijskog programa iz područja reprodukcije i razvoja u obliku 22 znanstveno-istraživačka zadatka koje su predložili pojedini voditelji. Na svojoj sjednici održanoj 27. siječnja 2009. godine Fakultetsko vijeće Medicinskog fakulteta Sveučilišta u Zagrebu usvojilo je prijedlog gore spomenutog translacijskog programa.
Program se provodi u preko 30 domaćih suradnih zdravstvenih institucija. U programu sudjeluju i 24 ugledne međunarodne institucije. Užu radnu skupinu čine djelatnici Zavoda za histologiju Medicinskog fakulteta te Klinika za urologiju i Klinika za ženske bolesti i porode Medicinskog fakulteta i KBC-a Zagreb.
Uz uobičajene aktivnosti na pojedinim znanstveno-istraživačkim zadatcima Odjel je pokrenuo i uvođenje novih zdravstvenih usluga iz područja medicinske oplodnje u sustavu javnog zdravstva RH, a koje bi zajednički pružali Medicinski fakultet i KBC Zagreb: osnivanje i registraciju Banke biopsije sjemenika (na razini Republike Hrvatske) i Centra za andrologiju u sklopu Klinike za urologiju. U tijeku je rad na adaptaciji prostora i nabavi opreme za Banku i Centar te se očekuje dobivanje dopusnice za rad od strane Ministarstva zdravlja.
Voditelj
Prof. dr. sc. Davor Ježek
E-mail: davor@mef.hr
Djelatnici
- prof. dr. sc. Davor Ježek, dr. med.
- prof. dr. sc. Ljerka Banek, dr. med.
- prof. dr. sc. Đurđica Grbeša, dr. med.
- prof. dr. sc. Gordana Jurić-Lukić, dr. med.
- doc. dr. sc. Željka Vukelić
- Andreja Vukasović, dr. med., znanstvena novakinja
- Željka Punčec, medicinsko-laboratorijski ing.
- Mirela Vranić, bacc. medicinsko-laboratorijske dg.
- Iris Elezović, medicinsko-laboratorijski ing.
- Adriana Čuljak, kemijska tehničarka
- Goran Kapustić, kemijski tehničar
Odjel za proteomiku
O odjelu

Proteini imaju važnu ulogu u stanicama i tkivima primarno u održavanju strukturnog integriteta, kataliziranju brojnih procesa te regulaciji genske ekspresije. Proteomika je znanstvena disciplina koja se bavi proučavanjem građe, funkcije i interakcija staničnih proteina. Za razliku od genoma koji je brojčano lakše definirati, proteom je skup svih proteina koji je zbog brojnih post-translacijskih modifikacija proteina značajno kompleksniji. Osim veličine, vremenske i prostorne dinamičnosti, proteom je kompleksan primarno zbog dinamičkog raspona proteina u nekom biološkom sustavu.
Odjel za proteomiku djeluje pri Centru za translacijska i klinička istraživanja u sklopu kojega radi na razvoju proteomskih metoda kojima se sustavno proučava struktura i funkcija proteina. Ovisno o uzorku, one se mogu koristiti za ispitivanje ukupnog proteoma organizma, pojedinog organa, određenog signalnog puta, pojedinačne stanice, ali i detaljno istraživanje strukture pojedinog proteina..
Temeljna područja istraživanja Odjela za proteomiku obuhvaćaju:
- Definiranje potencijalnih terapijskih targeta kod rijetkih koštanih bolesti, koštanih prijeloma i odgođenog cijeljenja
- Nadogradnju platforme za koštanu regeneraciju uporabom novih autolognih formulacija
- Testiranje pojavnosti novih biljega otkrivenih proteomskom analizom u prognozi i praćenju pojedinih tumorskih stanja
- Istraživanja u području inflammaging-a kao osnove i ključne komponente patoloških promjena i regeneracije (fibroza i njena poveznica s mnogobrojnim patološkim procesima/bolesti jetre, bubrega, kože)
- Definiranje statusa i validacije novih biljega (Biomarkera)
Uporaba proteomike i spektrometrije masa u području biomedicine podrazumijeva translaciju znanja od temeljnih istraživanja do kliničke primjene rezultata, odnosno izravno usmjeravanje novo stečenih znanja u buduće kliničke odluke i intervencije. U praktičnom smislu to se odnosi na usporedbu proteomskih profila pojedinih tkiva (ili bioloških tekućina) u zdravih i oboljelih pacijenata te otkrivanje potencijalnih razlika u ekspresiji ili razini ekspresije ciljanih proteina.
Odjel od 2008. godine do danas
Odjel za proteomiku osnovan je 10. lipnja 2008., te je prvi voditelj odjela bio akademik Slobodan Vukičević, uz tadašnje suradnike prof. dr. sc. Lovorku Grgurević i konzultanta dr. Borisa Mačeka (tada Institut za biokemiju Max Planck, Martinsried, Njemačka). Od 2016. godine voditelj Odjela za proteomiku postaje prof.dr.sc. Lovorka Grgurević zajedno sa svojim najbližim suradnikom i djelatnikom Odjela dr. sc. Ruđerom Novakom, dipl. inž. biol., te suradnicima: Stela Hrkač dr.med, Grgur Salai dr.med. te Joško Bilandžić, student.
Gdje se nalazimo?
Odjel za proteomiku nalazi se u prostoru na adresi Šalata 2, 2. kat u dva laboratorija i jednom uredskom prostoru. Preparativni laboratorij je površine oko 15 m2, analitički LC-MS laboratorij je površine oko 48 m2, a uredski prostor također 15 m2.
Što nudimo?
- Konzultacije oko eksperimentalnog dizajna
- Priprema uzoraka (ekstrakcija proteina iz plazme, seruma, sline, likvora, stanica, tkiva, ili tkiva fiksiranih formalinom; digestija proteina, priprema uzoraka za bottom-up proteomski pristup)
- Tekućinska kromatografija i masena spektrometrija (proteomski pristup ili sekvenciranje pojedinačnih proteina)
- Western blot, ELISA, izoelektrično fokusiranje
- Obrada podataka te bioinformatička analiza
- Interpretacija rezultata
- Znanstvena edukacija nove generacije istraživača u području funkcionalne proteomike
Oprema
- Thermo Scientific LTQ Orbitrap Discovery. Kao jedan od osnovnih uređaja Odjela za proteomiku, uz svesrdnu pomoć KBC Zagreb, Medicinskog fakulteta i Ministarstva znanosti, 2008. godine je kupljen vrhunski maseni spektrometar visokog razlučivanja LTQ Orbitrap Discovery (Thermo Fisher Scientific) čije su glavne funkcije karakterizacija velikog broja proteina i peptida u raznim bolestima te farmakokinetička istraživanja.
- HPLC ThermoScientific UltiMate 3000.
- Standardna oprema za elektroforezu (SDS PAGE, Western blot) uključujući i horizontalni sustav za izoelektrično fokusiranje Serva HPE Blue horizon
- Ostala sitna laboratorijska oprema (rashladne centrifuge, vakuum uparivač, termoblokovi i sl.)
Suradnje
Od 2016. godine Odjel intenzivno radi na ostvarenju glavnog cilja a to je promicanje translacijskih istraživanja udruživanjem programa s područja bazičnih i kliničkih medicinskih istraživanja. Uz to dio naših multidisciplinarnih suradnji ostvaruje se i s istraživačkim grupama iz područja biologije i kemije. Odjel aktivno radi na programima u sklopu projekta Znanstvenog Centra Izvrsnost ( ZCI) -„Reproduktivna i regenerativna medicina – istraživanja novih platformi i potencijala“, projekt Znanstvenog centra izvrsnosti za reproduktivnu i regenerativnu medicinu, „OSTEOGROW“ - Novel Bone Morphogenetic Protein 6 Biocompatible Carrier Device for Bone Regeneration, FP7 HEALTH projekt, „OSTEOproSPINE - Novel Bone Regeneration Drug Osteogrow: Therapeutic Solution for Lumbar Back Pain“, HORIZON 2020 Uspostavni istraživački projekt Hrvatske zaklade za znanost „Novootkrivene cirkulirajuće izoforme BMP1 proteina kao biomarkeri i terapijski ciljevi za humane bolesti“ kao i brojnih drugih znanstvenih projekta.
Usluge Odjela za proteomiku dostupne su svim Odjelima, Laboratorijima i Zavodima Medicinskog fakulteta Sveučilišta u Zagrebu. Uspostavljene su dugogodišnje suradnje s Institutom Ruđer Bošković, Veterinarskim fakultetom u Zagrebu, Stomatološkim fakultetom u Zagrebu, KBC Sestre milosrdnice, KB Dubrava, KBC Zagreb Rebro, Klinikom za dječje bolesti, Klinikom za tumore, Kliničkom bolnicom Merkur i privatnim poliklinikama. Odjel blisko surađuje u smislu vanjske konzultacije s Prof. Dr.sc. Borisom Mačekom koji trenutno obnaša funkciju Direktora Proteomskog Centra na Sveučilištu u Tuebingenu.
Naša uloga
Uloga Odjela za proteomiku u sklopu Centra za translacijska istraživanja izuzetno je važna sagledavajući je s nekoliko strana. Biomedicinska istraživanja bolesti više ne opisujemo djelovanjem jednog proteina, već složenim međusobnim odnosima više proteina na globalnoj skali. U „post-genomskom“ razdoblju, upravo proteomske metode igraju važnu ulogu u razumijevanu patofizioloških osnova bolesti i otkrivanju njihovih biljega.
Istraživanjima se usmjeravaju odluke i intervencije, a u bližoj se budućnosti predviđa i rutinska klinička identifikacija modificiranih peptida, proteina ili skupina proteina povezanih s određenom bolesti. Rastuća kompleksnost biomedicinskih istraživanja zahtijeva tijesnu suradnju između bazičnih i kliničkih znanstvenika educiranih u primjeni najnovijih tehnologija i znanja u cilju unaprjeđenja ljudskog zdravlja i poboljšanja zdravstvene skrbi.
Uz navedeno, Odjel za proteomiku dugi niz godina sudjeluje u izvođenju nastave na nekoliko poslijediplomskih kolegija na Medicinskom i Stomatološkom fakultetu Sveučilišta u Zagrebu. Na ovaj način polaznicima se približava znanstvena metoda, prenose se temeljne spoznaje o mogućnostima proteomskih istraživanja, ali i otvara mogućnost novih znanstvenih suradnji, što je osobit cilj Odjela.
Zbog svega navedenog, uloga i postojanje odjela za proteomiku je ključna u sklopu svake veće znanstveno orijentirane institucije.
Voditelj
Prof. dr. sc. Lovorka Grgurević
E-mail: lgrgurev@mef.hr; lovorka.grgurevic@mef.hr
https://www.bib.irb.hr/pregled/znanstvenici/227434
https://scholar.google.hr/citations?user=804trCoAAAAJ&hl=hr
Djelatnici
dr. sc. Ruđer Novak, viši znanstveni suradnik
Suradnici
Stela Hrkač, dr. med.
Grgur Salai. dr. med.
Joško Bilandžić, student

Laboratorij za mineralizirana tkiva
O laboratoriju
U Centru za translacijska i klinička istraživanja najdužu tradiciju ima Laboratorij za mineralizirana tkiva. Osnovan je još davne 1986. godine. Od tada se laboratorij prostorno širio i kontinuirano opremao te je danas opremljen svom opremom potrebnom za suvremeni istraživački rad. Nastamba za pokusne životinje (miševi, štakori, kunići) 2011. je registrirana za provođenje pokusa na životinjama te je Laboratoriju odobren uzgoj i opskrba životinjama koje se koriste u pokusima (rješenje Uprave za veterinarstvo Ministarstva poljoprivrede, ribarstva i ruralnog razvoja).
Od 2007. godine istraživanja se šire prema mehanizmima djelovanja koštanih morfogenetskih proteina (engl. bone morphogenic protein, BMP) u tkivima poput bubrega, jetre, gušterače kao i otkrivanju novih biomarkera u raznim bolestima. U zadnjih par godina istraživanja su proširena na ulogu BMP-a u regulaciji metabolizma željeza i glukoze kao i na utjecaj serotonina na koštani sustav.
U zadnjih pet godina Laboratoriju je odobren za financiranje veći broj projekata među kojima posebno treba istaknuti EU FP7 projekt “OSTEOGROW” na kojem je Medicinski fakultet u ulozi koordinatora konzorcija od jedanaest partnera, projekt „OSTEOproSPINE“ (Horizon 2020) koji se sadržajem nastavlja na projekt „OSTEOGROW“, projekt „Reproduktivna i regenerativna medicina – istraživanja novih platformi i potencijala (KK.01.1.1.01.0008)“ Znanstvenog centra izvrsnosti za reproduktivnu i regenerativnu medicinu i projekt „BMP6Fe3 - Razvoj novih antitijela (biološki lijek) koja selektivno inhibiraju izražaj hepcidina u jetri za terapiju anemije kronične bolesti“ (Hrvatska zaklada za znanost). Laboratorij kontinuirano ostvaruje niz suradnji s međunarodnim i domaćim znanstvenim institucijama. Jednu od vodećih pozicija Laboratorija u znanstveno-istraživačkom radu u Republici Hrvatskoj dokazuje velik broj publiciranih radova i izrađenih doktorskih disertacija koje su rezultat dugogodišnjeg predanog rada.
Otkriće strukture i funkcije gena i proteina iz super obitelji TGF-beta
Višegodišnja istraživanja u suradnji sa svjetski poznatim laboratorijima rezultirala su brojnim radovim i dovela do kliničke primjene rekombinantnih koštanih morfogenetskih proteina u humanoj medicini za ubrzavanje i poticanje nastanka kosti u pacijenata sa spinalnom fuzijom, akutnim prijelomom i nesrastanjem kosti. Više od 30.000 pacijenata širom svijeta uspješno je kirurški tretirano koštanim morfogenetskim proteinima. Uloga BMP-a u regeneraciji kostiju, bubrega i zglobne hrskavice je opsežno istražena, a postavljeni su i temelji za uporabu BMP7 u pacijenata s akutnim i kroničnim bubrežnim zatajenjem. Osim toga, u sklopu projekata „OSTEOGROW“ i „OSTEOproSPINE“ u suradnji s klinikama u Hrvatskoj i Austriji provode se kliničke studije uporabe BMP6 u nekoliko ortopedskih indikacija. Ovo kompleksno područje istraživanja postalo je glavnim područjem istraživanja u Laboratoriju i rezultiralo je s više od 4200 citata u radovima drugih znanstvenika.
Najvažniji doprinosi Laboratorija znanosti u području BMP-a su:
- Otkriće hrskavičnih morfogenetskih proteina (CDMP-1, -2 i – 3; također nazvani GDF-5, -6 i -7 ili BMP12, -13 i -14) i proteina prostate (PDF; također nazvan BMP11)
- Purifikacija i in vitro uloga BMP-a radi dokazivanja njihove sposobnosti da diferenciraju prekursorske stanice osteoblasta u potpuno diferencirane osteoblaste i preusmjere inhibitorni učinak TGF-beta na staničnu diferencijaciju. Isti princip je kasnije potvrđen u suradnji sa znanstvenicima sveučilišta u Leidenu i Bernu kao glavni mehanizam pomoću kojeg TGF-beta inducira transformaciju epitela u mezenhim u raku prostate i dojke
- Karakterizacija tkiva i organa koji proizvode koštane morfogenetske proteine na razini mRNA i proteina u tijeku embrionalnog razvoja kao i u postnatalnom životu
- Sistemska primjena BMP6 obnavlja volumen kosti i mikroarhitekturu u starih ovarijektomiranih štakora povećanjem koštane izgradnje i inhibicijom resorpcije kosti
- Otkriće različitih izoformi BMP1 proteina (metaloproteinaze mTld), prvenstveno izoforme BMP1-3, i njezin utjecaj na fibrozu
Nove formulacije lijeka OSTEOGROW
U sklopu istraživanja regenerativne uloge BMP6 ispituju se nove formulacije lijeka OSTEOGROW (BMP6 u autolognom krvnom ugrušku kao nosaču) koje uključuju primjenu sintetske biokompatibilne keramike na bazi kalcijevog fosfata u cilju dobivanja boljih biomehaničkih svojstava lijeka. Nadalje, dio istraživanja usmjeren je na ispitivanje odnosno usporedbu lijeka OSTEOGROW s komercijalno dostupnim napravama za stvaranje nove kosti. Pretklinička istraživanja su pokazala brojne prednosti OSTEOGROW naprave, u odnosu na već postojeće.
Uloga BMP3 u nastanku i regeneraciji koštanog tkiva
U Laboratoriju se istražuje i uloga koštanog morfogenetskog proteina 3 (BMP3), divergentnog člana BMP obitelji proteina, koji antagonizira djelovanje ostalih BMP-a, u nastanku i regeneraciji koštanog tkiva. Iako je najrasprostranjeniji protein iz ove skupine proteina u koštanom tkivu, istraživanja o BMP3 su malobrojna i nedostatna. Do sada nije proučavan utjecaj BMP3 na regeneraciju kosti, kao ni njegovo međudjelovanje sa proteinom BMP6. Za ove potrebe koriste se stanični in vitro modeli, koji uključuju mezenhimalne matične stanice koštane srži te stanične linije C2C12 i MC3T3, kao i miševi sa izbačenim genom za BMP3. U istraživanjima in vivo promatra se djelovanje BMP3 na ektopično stvaranje kosti te utjecaj na cijeljenje prijeloma.
Antifibrozna terapija u urođenoj mišićnoj distrofiji s mutacijom u lamininu na modelu miša
Urođena mišićna distrofija s nedostatkom merozina (MDC1A) je autosomno recesivan oblik mišićne distrofije karakteriziran mišićnom slabošću vidljivom pri porodu ili u prvih šest mjeseci života, a pritom je i druga najčešća vrsta od svih mišićnih distrofija. Ovaj oblik mišićne distrofije često ima vrlo agresivnu patologiju te u mnogim slučajevima može dovesti do prerane smrti kod djece zbog respiratornih problema i zbog usporenog napredovanja i rasta. U ovom trenutku nema učinkovite terapije koja bi imala pozitivan učinak na ovu bolest i zbog toga postoji želja za identificiranjem što boljeg i uspješnijeg tretmana. Lama2 DyW je mišji model za urođenu mišićnu distrofiju s mutacijom u lama2 genu koji se koristi u ovom istraživačkom radu i kojeg Laboratorij za mineralizirana tkiva posjeduje od početka 2020. godine. Miševi borave u kontroliranim uvjetima (temperatura, tlak, vlaga, ventilacija, ciklus dana i noći) u posebnim ventiliranim kabinetima. Ovaj mišji soj je veoma osjetljiv, a homozigotne jedinke žive do četiri tjedna te je pokuse trebalo strateški i pomno pripremiti i usavršiti. Miševi koji primaju antifibrozni tretman, kojim se pomoću specifičnih protutijela inhibira učinak BMP1-3 proteina, pokazuju odlične rezultate na biokemijskoj, histološkoj i bihevioralnoj razini, a u nadi smo da će i budućnost donijeti mnoštvo izvrsnih rezultata. Rezultati ovog istraživanja mogli bi omogućiti razvoj nove ciljane terapije za stanje za koje trenutno postoje samo empirijska palijativna rješenja.
Učinak BMP6 i serotonina na metabolizam glukoze i koštani metabolizam
U dosadašnjim istraživanjima Laboratorija za mineralizirana tkiva uloga BMP6 uočena je, osim u koštanom metabolizmu, i u homeostazi glukoze, dok prethodna istraživanja ukazuju na ulogu serotonina (5HT) u koštanom metabolizmu i regulaciji endokrine funkcije gušterače. Međusobni utjecaj BMP6 i 5HT na metabolizam glukoze i koštani metabolizam do sada nije istražen te se pretpostavlja da su BMP6 i 5HT u međusobnoj interakciji i da sinergistički djeluju na metabolizam glukoze, a posljedično i na koštani metabolizam. Na staničnoj liniji endokrinih stanica gušterače istražuje se učinak BMP6 i 5HT na stanične procese vezane uz metabolizam glukoze, lučenje inzulina i 5HT sustav, a preliminarni rezultati ukazuju da BMP6 utječe na pojačanu aktivnost serotoninskog sustava u uvjetima povećane koncentracije glukoze. U planu su i istraživanja in vivo na miševima s ciljano izbačenim genom za BMP6 (knockout miševima). Cilj ovih istraživanja je utvrditi postoji li funkcionalna povezanost između BMP6, 5HT i metabolizma glukoze, što će doprinijeti boljem razumijevanju njihove uloge u organizmu i omogućiti istraživanja novih strategija za liječenje dijabetesa.
Uloga dentinskog matriksnog proteina 1 (DMP1) u stvaranju i regeneraciji kosti
Istražuje se potencijalna uloga DMP1, molekule odgovorne za formaciju dentina, u procesima regeneracije i stvaranja kosti. Istraživanje se provodi na mišjim stanicama preosteoblasta (MC3T3) a djelovanje i potencijalni doprinos DMP1 testirat će se također in vivo u potkožnom eseju te u cijeljenju prijeloma. Istraživanje se provodi u suradnji sa Chicago College of Dentistry (University of Illinois, Chicago, SAD).
Suradnja s drugim laboratorijima
Zaposlenici Laboratorija surađuju na brojnim projektima u i izvan Republike Hrvatske. Mikro-CT uređaj, dostupan u Laboratoriju, čini osnovu proučavanja mineraliziranih tkiva jer omogućuje detaljnu vizualizaciju i kvantifikaciju koštanih parametara. Laboratorij za mineralizirana tkiva ostvario je suradnje na projektima Sveučilišta u Zagrebu BioCOMET, BioCHIP i HIPoCART te u suradnji sa Medicinskim fakultetom Sveučilišta u Rijeci.
Voditelj
Prof. dr. sc. Slobodan Vukičević
Djelatnici
- prof. dr. sc. Slobodan Vukičević, voditelj Laboratorija
- dr. sc. Vera Kufner, znanstvena suradnica
- dr.sc. Igor Erjavec, znanstveni suradnik
- dr.sc. Tatjana Bordukalo Nikšić, znanstvena suradnica
- dr.sc. Nikola Štoković, dr. med., docent
- dr.sc. Natalia Ivanjko, mag. ing. biotechn., asistentica doktorandica
- Ivona Matić Jelić, mag. chem., asistentica doktorandica
- Viktorija Rumenović, mag. mol. biol., asistentica doktorandica
- Marina Milešević, mag. ing. biotechn., asistentica doktorandica
- Ema Velčić Kruneš, dr.med.vet., stručni suradnik
- Lucija Rogina, mag. ing. tech. aliment., stručna suradnica, doktorandica
- Ivančica Bastalić, prof., osobna asistentica
- Romana Blažek, tajnica
- Đurđica Car, tehničarka
- Mirjana Marija Renić, tehničarka
Znanstveni projekti
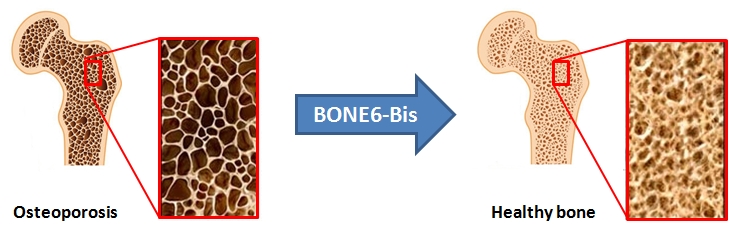
Projekt HZZ: BONE6-BIS
A novel anabolic targeted therapy for osteoporosis: BONE6-BIS consortium
January 1st 2012 – December 31st 2014
PROJECT INFORMATION
Purpose
The purpose of the project is to develop a new therapeutic, BONE6-BIS, which will represent an efficient and safe drug for the treatment of osteoporosis. BONE6-BIS is a “chimeric” molecule which consists of a Bone Morphogenetic Protein 6 (BMP6) and bisphosphonate. Bisphosphonate, a small molecule, targets the molecule to the bone surface where BMP6 would exert its action and induce bone regeneration.
Disease and current treatments
Osteoporosis, which literally means “porous bones,” is a disease characterized by a reduction in bone density. Osteoporosis occurs when the normal repeating cycle of osteoclast (bone resorption) and osteoblast (bone formation) activity is misaligned resulting in bone resorption being greater than formation. This process leaves the bones brittle and prone to fracture spontaneously or after a minor accident, with the spine, wrists and hips being most susceptible. Unfortunately, osteoporosis is a silent disease and can progress painlessly for years until a severe injury occurs. According to the National Osteoporosis Foundation (NOF), osteoporosis is a major health threat to 55% of people age 50 and over. While it’s a largely preventable disease, there is no cure.
There are several prescription medications used to treat osteoporosis. Bisphosphonates are the most commonly prescribed drugs for treatment of osteoporosis; they accumulate in bone matrix and can slow bone loss and increase bone density thus reducing the risk of fracture. Drugs called selective estrogen receptor modulators (SERMs) can act like estrogen to help prevent bone loss. Calcitonin, a hormone that your body naturally produces, may also be taken to help slow bone loss for some patients. Hormone or estrogen replacement therapy may also help prevent osteoporosis in postmenopausal women.
Goal
We have recently discovered that BMP6 may have specific therapeutic advantages as compared to other BMP family members in inducing regeneration of bone, pancreatic β-islets and kidney tubule epithelium. We demonstrated that BMP6 increases the bone volume when administered systemically to ovariectomized aged rats. In this project we will, for the first time, thoroughly characterize the naturally occurring BMP forms and complexes in blood and develop reliable assays for quantifying BMP6 in plasma and then express recombinant human (rh)BMP6 in its natural form.
Following production of rhBMP6 we aim to develop a novel anabolic therapy for osteoporosis via targeting rhBMP6 to bone surfaces by attaching it to a bisphosphonate which can be cross-linked to the protein via lysine residues.
PROJECT PARTICIPANTS
Project Leader – Professor Slobodan Vukičević, MD, PhD
Center for Translational and Clinical Research, School of Medicine, University of Zagreb
Assistant Professor Lovorka Grgurević, MD, PhD
Assistant Professor Donatella Verbanac, PhD
Jelena Brkljačić, BSc
Genadij Razdorov, BSc
Martina Pauk, BSc
Igor Erjavec, BSc
Genera Research
Hermann Oppermann, MD, PhD
Morana Jankolija, BSc
Anamarija Olić, BSc
Irena Popek, BSc
Marina Martinić, BSc
Clinical Hospital Center Zagreb
Assistant Professor Zlatko Giljević, MD, PhD
Assistant Professor Mislav Jelić, MD,PhD
Professor Darko Antičević, MD,PhD
Mislav Cerovec, MD,PhD
Živka Dika, MD,PhD
Antonio Cipčić, BSc
Croatian Academy of Science and Arts
Academy member Marko Pećina, MD, PhD
Igor Borić, MD, PhD
FUNDING
This project is funded by Croatian Science Foundation.
Total funding: 1.439.800,00 HRK
NEWS
22nd March 2012
Lecture invitation
22nd October 2012
PUBLICATIONS
Prior Art
Vukicevic S, Grgurevic L. BMP-6 and mesenchymal stem cell differentiation. Cytokine Growth Factor Rev 20:441-8, 2009.
Simic P, Culej JB, Orlic I, Grgurevic L, Draca N, Spaventi R, Vukicevic S. Systemically administered bone morphogenetic protein-6 restores bone in aged ovariectomized rats by increasing bone formation and suppressing bone resorption. J Biol Chem 281:25509-21, 2006.
USEFUL LINKS
Croatian Science Foundation: http://www.hrzz.hr/
Croatian Ministry of Science, Education and Sports: http://public.mzos.hr/
European Calcified Tissue Society: http://www.ectsoc.org/
International Osteoporosis Foundation: http://www.iofbonehealth.org/
National Osteoporosis Foundation: http://www.nof.org/
HRZZ: MINUTE for IBD

Assessment of Microbiota, Inflammatory Markers, Nutritional and Endocrinological Status in IBD Patients
Acronym: MINUTE for IBD
September 1st 2014 – August 31st 2018
SAŽETAK
Upalna bolest crijeva (IBD) predstavlja kronični proces u probavnom traktu sa sve većom učestalošću, koji značajno pogoršava kvalitetu života pacijenata. Nastanak bolesti povezan je s imunim statusom, sastavom crijevne mikrobiote te unosom hrane. Trenutne znanstvene spoznaje o specifičnim pokretačima i dijagnostičkim markerima bolesti su ograničene, te su za bolje razumijevanje patofiziologije IBD neophodne nove informacije o sastavu crijevne mikrobiote, imunom, endokrinom i prehrambenom statusu pacijenata.
Projektom će biti detaljno istražena crijevna mikrobiota u uzorcima biopsije crijeva, stolice i krvi od 40 novo-dijagnosticiranih IBD pacijenata i 20 ne-IBD pojedinaca, kao i nutritivni i endokrini sastav svakog ispitanika. Za proučavanje sastava mikroorganizama iz uzoraka bit će korištena metoda sekvenciranja nove generacije, dok će u svrhu detekcije biomarkera iz krvi biti korištena vrlo osjetljiva metoda proximity extension assay (PEA). Dobiveni će rezultati omogućiti bolju stratifikaciju IBD pacijenata te ih lakše usmjeriti prema odgovarajućoj terapiji sukladno principima personaliziranog pristupa.
ABSTRACT
Inflammatory bowel disease (IBD) is a chronic gastrointestinal disorder with increase in incidence that severely deteriorates patients’ quality of life. The onset of the disease is mainly associated with the immune status, gut microbiota and food intake. The current scientific knowledge of specific triggers and diagnostic markers is limited; therefore, new data on gut microbiota, inflammatory, endocrine and nutritional status are required to better understand the IBD pathophysiology.
In this study we will thoroughly explore host-gut microbiota interactions in order to define novel strategies for management of IBD. We will collect intestine biopsies, stool and blood samples from 40 newly diagnosed IBD patients and 20 non-IBD control individuals, as well as record their nutritional status. Since majority of the gut microorganisms are not culturable, we will use the in house available next-generation sequencing to characterize the composition of the microbiota in collected samples. Moreover, specific blood biomarkers, including cytokines, growth factors and hormones, will be determined using novel and highly sensitive proximity extension assays, recently developed in our laboratories. Collectively, these results will support better stratification of patients and initiate an appropriate therapy.
PROJECT PARTICIPANTS
University of Zagreb School of Medicine
Project leader – Assistant Professor Donatella Verbanac, PhD
Mihaela Perić, PhD
Mario Matijašić, PhD
Hana Čipčić Paljetak, PhD
Vera Kufner, PhD
Marina Panek, mag.biol.mol.
University Hospital Centre Zagreb
Associate Professor Željko Krznarić, MD, PhD
Assistant Professor Silvija Čuković Čavka, MD, PhD
Marko Brinar, MD, PhD
Nikša Turk, MD, PhD
Assistant Professor Darija Vranešić, PhD
Mirjana Kalauz, MD, PhD
Ivana Kraljević, PhD
Dina Ljubas Kelečić, mag.pharm
Ana Kunović, MD
Dora Grgić, MD
Associate Professor Dunja Rogić, PhD
University Hospital Dubrava
Marija Crnčević Urek, MD, PhD
Associate Professor Marko Banić, MD, PhD
Fidelta Ltd. Zagreb
Karmen Brajša, PhD
Xellia Ltd. Zagreb
Gabrijela Ergović, PhD
Imperial College London
Anja Barešić, PhD
FUNDING
This project is funded by the Croatian Science Foundation.
Total funding: 998.400,00 HRK
SCIENTIFIC PAPERS PUBLISHED
1. Meštrović T, Matijašić M, Perić M, Čipčić Paljetak H, Barešić A, Verbanac D. The Role of Gut, Vaginal, and Urinary Microbiome in Urinary Tract Infections: From Bench to Bedside. Diagnostics (Basel). 2020 Dec 22;11(1):E7. doi: 10.3390/diagnostics11010007.
2. Matijašić M, Meštrović T, Paljetak HČ, Perić M, Barešić A, Verbanac D. Gut Microbiota beyond Bacteria-Mycobiome, Virome, Archaeome, and Eukaryotic Parasites in IBD. Int J Mol Sci. 2020 Apr 11;21(8):2668. doi: 10.3390/ijms21082668.
3. Leskovar D, Meštrović T, Barešić A, Kraljević I, Panek M, Paljetak HČ, Perić M, Matijašić M, Rogić D, Barišić A, Kelečić DL, Bender DV, Krznarić Ž, Verbanac D. The Role of Vitamin D in Inflammatory Bowel Disease - Assessing Therapeutic and Preventive Potential of Supplementation and Food Fortification. Food Tech Biotech 2018, 56(4), 455-463, DOI: 10.17113/ftb.56.04.18.5805
4. Panek M, Čipčić Paljetak H, Barešić A, Perić M, Matijašić M, Lojkić I, Vranešić Bender D, Krznarić Ž, Verbanac D. Methodology challenges in studying human gut microbiota - effects of collection, storage, DNA extraction and next generation sequencing technologies. Sci Rep. 2018 Mar 23;8(1):5143. doi: 10.1038/s41598-018-23296-4. (top 100 articles in Sci Rep for 2018)
5. Matijašić M, Meštrović T, Perić M, Čipčić Paljetak H, Panek M, Vranešić Bender D, Ljubas Kelečić D, Krznarić Ž, Verbanac D. Modulating Composition and Metabolic Activity of the Gut Microbiota in IBD Patients. Int. J. Mol. Sci. 2016, 17, 578; doi:10.3390/ijms17040578
FP7: Osteogrow
IRI: PROBITECT
Sinergijska inovativna kombinacija sastavnica mikrobiote kao osnova za razvoj inovativnih topikalnih proizvoda za tretiranje i prevenciju upalnih stanja humane kože - PROBITECT
August 16, 2020 – August 15, 2023
SURADNE INSTITUCIJE
PROTEKO d.o.o.
Mirta Mikulecky
Iva Ačkar
Tamara Kajfeš Hrgovan
Vanja Premzl
MEF
Mihaela Perić
Hana Čipčić Paljetak
Mario Matijašić
Dora Hrestak
Smiljka Vikić-Topić
Daniela Ledić Drvar
SAŽETAK
Atopijski dermatitis i sindrom osjetljive kože najčešća su kronična upalna stanja kože kod ljudi. Najnovija istraživanja ukazuju na velik značaj mikrobiote kože (svi živi mikroorganizmi na koži) na zdravlje kože. Kako bi se doprinijelo potrebama pacijenata i tržišta u sklopu projekta razvit će se topikalni pripravci na bazi humane mikrobiote, izuzetno dobrog profila dermatološke kompatibilnosti koji u odnosu na konvencionalne alternative nemaju nuspojava pri primjeni i koji se smiju koristiti bez recepta i nadzora liječnika te na taj način smanjuju financijsko opterećenje na zdravstveni sustav, a poboljšavaju kvalitetu života tih pacijenata.
Ciljne skupine projekta su: globalna populacija, pacijenti s kroničnim upalnim stanjima kože.
CILJ PROJEKTA
Cilj i svrha projekta je razviti proizvod do faze TLR 8 prema kojoj će isti biti na visokoj razini tehnološke spremnosti za komercijalizaciju na globalnom tržištu. Unutar projekta će biti razvijena nova inovativna formulacija topikalnog pripravka, riješeni tehnološki rizici i proizvodni problemi što će rezultirati topikalnim pripravcima na bazi humane mikrobiote i njihovih derivata, izuzetno dobrog profila klinički ispitane dermatološke biokompatibilnosti. Nova, inovativna znanstvena i tehnološka rješenja topikalnih pripravaka za pacijente s kroničnim upalnim stanjima kože kao atopijski dermatitis (AD) i sindrom osjetljive kože (SOK) bit će klinički testirana sa svrhom ispitivanja povećane učinkovitosti, smanjenja nuspojava te poboljšanja kvalitete života tih pacijenata u odnosu na konvencionalne alternative – lokalne kortikosteroide, te sa svrhom poboljšanja spektra djelovanja i time učinkovitosti u tretiranju AD u odnosu na dostupne alternative kortikosteroidima. Dodatnu tržišnu vrijednost predstavlja i njihovo planirano korištenje bez recepta i nadzora liječnika čime će se smanjiti financijsko opterećenje zdravstvenih sustava i poboljšati pristup pacijenata učinkovitim rješenjima za njihove tegobe. Obzirom na epidemiološke podatke, koristi od
formulacije za AD imat će do 20% populacije, a od formulacije za SOK 38 do čak 70% populacije. Radi se o stanjima koja su globalno prisutna pa učinkovita rješenja imaju i globalni potencijal.
FINANCIRANJE
HAMAG-BICRO, IRI projekt KK.01.2.1.02.0137
12.986.807,92 HRK
IRI: SKINBIOTIC
Novi farmabiotici za primjenu u upalnim stanjima kože - SKINBIOTIC

1. studeni 2023. – 30. lipanj 2026.
SURADNE INSTITUCIJE
Medicinski fakultet Sveučilišta u Zagrebu (dr.sc. Mihaela Perić, voditelj projekta)
PROTEKO d.o.o.
Selvita d.o.o.
SAŽETAK
Disbioza kožne mikrobiote jedna je od karakteristika patogeneze upalnih stanja kože. Proizvodi zasnovani na mikrobioti koji ublažavaju simptome bolesti te moduliraju sastav i funkciju kožne mikrobiote, predmet su interesa znanstvenika i industrije.
Projekt SKINBIOTIC okuplja vrsne akademske istraživače i industrijske stručnjake s ciljem istraživanja potencijala različitih bakterijskih sojeva, njihovih pripravaka i produkata - farmabiotika, u ponovnoj uspostavi homeostaze kože te smanjenju upale. Dobiveni rezultati bit će zaštićeni, diseminirani i primijenjeni u realnom sektoru, te iskorišteni kao osnova budućih projekata usmjerenih razvoju inovativnih proizvoda za topikalnu primjenu u tretmanu upalnih stanja kože.
CILJ PROJEKTA
Cilj projekta je istražiti potencijal različitih bakterijskih sojeva, odnosno njihovih pripravaka i produkata, farmabiotika, u ponovnoj uspostavi homeostaze kože te ublažavanju simptoma i znakova upalnih stanja kože.
Specifični ciljevi projekta su:
- karakterizati potencijalne nove farmabiotike u in vitro/ex vivo kožnim modelima
- ispitati tehnološku izvodljivost (vijabilnost, formulacije, stabilnost) uvođenjem inovacija u tehnološke procese
- potvrditi koncept pilot ispitivanjem
- zaštititi novonastalo intelektualno vlasništvo i pokrenuti procese transfera tehnologije
- diseminirati rezultate projekta i osigurati nastavak suradnje kroz pripremu novih projektnih prijedloga
Predloženi projekt postavit će solidne temelje za buduće zajedničke napore konzorcija koji bi mogli rezultirati novim i inovativnim farmabioticima za topikalnu primjenu u tretmanu kože zahvaćene upalnim procesima.
FINANCIRANJE
Ministarstvo znanosti, obrazovanja i mladih, NPOO.C3.2.R3-I1.04.0240
2.049.310,02 EUR
IRI: ADRIROSA
Novi topikalni pripravci na bazi kompleksa jadranskih mikroalgi za tretman kože zahvaćene rozacejom - ADRIROSA
01.03.2025. – 29.02.2028.
SURADNE INSTITUCIJE
PROTEKO d.o.o.
COSMOFORM d.o.o.
Cosmetic code d.o.o.
Sveučilište u Zagrebu,Medicinski fakultet (dr.sc. Mihaela Perić, dr.sc. Mario Matijašić, dr.sc. Hana Čipčić Paljetak)
SAŽETAK
Rozaceja, složena kronična upalna dermatoza, izazov je za dermatologe i pacijente zbog multifaktorske etiologije i varijabilnih kliničkih manifestacija. Patofiziološki mehanizam rozaceje uključuje niz faktora, uključujući vaskularne, neurogene i imunološke komponente, s neravnotežom kožne mikrobiote i izlaganjem UV zračenju kao čimbenicima u pogoršanju simptoma.
U kontekstu razvoja terapijskih strategija, istraživanja su usmjerena na pronalaženje inovativnih i održivih pristupa koji bi ciljali navedene patofiziološke mehanizme bolesti. U tom smislu, mikroalge, mikroskopski organizmi koji obiluju bioaktivnim spojevima, pobuđuju sve veći interes, osnažen razvojem novih održivih tehnologija njihovog uzgoja. Iznimna biološka raznolikost mikroalgi omogućava proizvodnju širokog spektra tvari s pozitivnim dermatološkim učinkom, što ih čini potencijalno korisnim u terapiji kožnih bolesti.
Mikroalge mogu smiriti upalne reakcije inhibicijom proupalnih mehanizama, prevenirati reakcije preosjetljivosti, smanjiti neurogenu upalu, smanjiti eritem, uravnotežiti mikrobiotu kože, poboljšati kvalitetu kožne barijere, stabilizirati vaskularnu funkciju te povećati otpornost kože na vanjske utjecaje. Ova svojstva ne mogu se pripisati pojedinom aktivnom sastojku već kompleksnoj prirodnoj smjesi aktivnih spojeva prisutnih u mikroalgama, poput karotenoida, peptida, proteina, pigmenata, oligosaharida, fenolnih spojeva i esencijalnih masnih kiselina. Te aktivnice ciljaju na veliki broj patogenetskih mehanizama uključenih u nastanak i razvoj rozaceje. Njihova topikalna primjena omogućava lokalno djelovanje na kožu smanjujući rizik od neželjenih sistemskih učinaka.
CILJ PROJEKTA
Cilj projekta je istražiti mogućnosti primjene različitih mikroalgi, tj. njihovih pripravaka, u ponovnoj uspostavi homeostaze kože, ublažavanju simptoma i znakova upalnih stanja kože te razviti proizvod do faze TRL 8, čime će isti biti na visokoj razini tehnološke spremnosti za globalnu komercijalizaciju. Dodatnu tržišnu vrijednost predstavlja i planirano korištenje proizvoda bez recepta i nadzora liječnika čime će se smanjiti financijsko opterećenje zdravstvenih sustava i poboljšati pristup pacijenata učinkovitim rješenjima za njihove tegobe.
Specifični ciljevi projekta su:
- karakterizirati potencijalne aktivnice na bazi mikroalgi u in vitro modelima,
- provjeriti tehničku izvedivost (formulacije, stabilnost, efikasnost) uvođenjem inovacija u tehnološke procese,
- provesti kliničko ispitivanje učinkovitosti,
- zaštititi novorazvijeno intelektualno vlasništvo (žig, patent).
FINANCIRANJE
Ministarstvo regionalnog razvoja i fondova Europske unije, IP.1.1.03.0157
2.750.300,61 EUR
Publikacije
ODJEL ZA MEĐUSTANIČNU KOMUNIKACIJU
- Rep V, Štulić R, Koštrun S, Kuridža B, Crnolatac I, Radić Stojković M, Čipčić Paljetak H, Perić M, Matijašić M, Raić-Malić S. Novel tetrahydropyrimidinyl-substituted benzimidazoles and benzothiazoles: Synthesis, antibacterial activity, DNA interactions and ADME profiling. RSC Medicinal Chemistry. 2022. doi: 10.1039/D2MD00143H
- Hana Čipčić Paljetak, Anja Barešić, Marina Panek, Mihaela Perić, Mario Matijašić, Ivana Lojkić, Ana Barišić, Darija Vranešić Bender, Dina Ljubas Kelečić, Marko Brinar, Mirjana Kalauz, Marija Miličević, Dora Grgić, Nikša Turk, Irena Karas, Silvija Čuković-Čavka, Željko Krznarić & Donatella Verbanac (2022) Gut microbiota in mucosa and feces of newly diagnosed, treatment-naïve adult inflammatory bowel disease and irritable bowel syndrome patients, Gut Microbes, 14:1, DOI: 10.1080/19490976.2022.2083419
- Hrestak, D.; Matijašić, M.; Čipčić Paljetak, H.; Ledić Drvar, D.; Ljubojević Hadžavdić, S.; Perić, M. Skin Microbiota in Atopic Dermatitis. Int. J. Mol. Sci. 2022, 23(7), 3503; https://doi.org/10.3390/ijms23073503
- Alihodžić, S.; Čipčić Paljetak, H.; Čikoš, A.; Elenkov, I.J. New Bicyclic Azalide Macrolides Obtained by Tandem Palladium Catalyzed Allylic Alkylation/Conjugated Addition Reaction. Molecules 2022, 27, 432. doi: 10.3390/molecules27020432
- Mackowiak, C.; Marchiol, T.; Čipčić Paljetak, H.; Fauconnier, L.; Palomo, J.; Secher, T.; Panek, C.; Sedda, D.; Savigny, F.; Erard, F.; Bragonzi, A.; Huaux, F.; Stoeger, T.; Schiller, H. B.; Sirard, J.-C.; Le Bert, M.; Couillin, I.; Quesniaux, V. F. J.; Togbe, D.; Ryffel, B. Chronic Pseudomonas aeruginosa Lung Infection Is IL-1R Independent, but Relies on MyD88 Signaling. ImmunoHorizons 2021, 5 (5), 273-283. doi: 10.4049/immunohorizons.2000095.
- E. Tanuhadi, N.I. Gumerova, A. Prado-Roller, M. Galanski, H. Čipčić-Paljetak, D. Verbanac, A. Rompel "Aluminum-substituted Keggin germanotungstate [HAl(H2O)GeW11O39]4-: Synthesis, Characterization and Antibacterial Activity." Inorg. Chem. 60 (2021) 28-31. doi: 10.1021/acs.inorgchem.0c03311
- E. Tanuhadi, E. Al-Sayed, A. Roller, H. Čipčić-Paljetak, D. Verbanac, A. Rompel "Synthesis, characterization and phosphoesterase activity of a series of 4f- and 4d- sandwich-type germanotungstates [(n-C4H9)4N]l/mH2[(M(H2O)3)(γ-GeW10O35)2] (M = CeIII, NdIII, GdIII, ErIII, l = 7; ZrIV, m = 6)." Inorg. Chem. 59 (2020), 14078–14084. doi: 10.1021/acs.inorgchem.0c01852
- Meštrović T, Matijašić M, Perić M, Čipčić Paljetak H, Barešić A, Verbanac D. The Role of Gut, Vaginal, and Urinary Microbiome in Urinary Tract Infections: From Bench to Bedside. Diagnostics (Basel). 2020 Dec 22;11(1):E7. doi: 10.3390/diagnostics11010007.
- Vukičević S, Perić M, Oppermann H, Štoković N, Ivanjko N, Erjavec I, Kufner V, Vnuk D, Bubić-Špoljar J, Pećin M, Novak R, Matić Jelić I, Bakić K, Milešević M, Blažević V, Rogina L, Vikić-Topić S, Božić T, Verbanac D, Bordukalo Nikšić T, Sampath KT, Pećina M, Matičić D, Grgurević L. Bone morphogenetic proteins: From discovery to development of a novel autologous bone graft substitute consisting of recombinant human BMP6 delivered in autologous blood coagulum carrier. Rad Hrvatske akademije znanosti i umjetnosti, Medicinske znanosti, 2020, DOI: https://doi.org/10.21857/y6zolb3l1m
- Durdevic D, Vlahovic T, Pehar S, Miklic D, Oppermann H, Bordukalo-Niksic T, Gavrankapetanovic I, Jamakosmanovic M, Milosevic M, Martinovic S, Sampath TK, Peric M, Grgurevic L, Vukicevic S. A novel autologous bone graft substitute comprised of rhBMP6 blood coagulum as carrier tested in a randomized and controlled Phase I trial in patients with distal radial fractures. Bone. 2020 Nov;140:115551. doi: 10.1016/j.bone.2020.115551.
- Peric M, Pešić D, Alihodžić S, Fajdetić A, Herreros E, Gamo FJ, Angulo-Barturen I, Jiménez-Díaz MB, Ferrer-Bazaga S, Martínez MS, Gargallo-Viola D, Mathis A, Kessler A, Banjanac M, Padovan J, Bencetić Mihaljević V, Munic Kos V, Bukvić M, Eraković Haber V, Spaventi R. A novel class of fast-acting antimalarial agents: Substituted 15-membered azalides. Br J Pharmacol. 2020 Oct 21. doi: 10.1111/bph.15292.
- Chiari, C., Grgurevic, L., Bordukalo‐Niksic, T., Oppermann, H., Valentinitsch, A., Nemecek, E., Staats, K., Schreiner, M., Trost, C., Kolb, A., Kainberger, F., Pehar, S., Milosevic, M., Martinovic, S., Peric, M., Sampath, T.K., Vukicevic, S. and Windhager, R. Recombinant human BMP6 applied within Autologous Blood Coagulum accelerates bone healing: Randomized controlled trial in High Tibial Osteotomy patients. 2020, J Bone Miner Res. doi:10.1002/jbmr.4107
- Grgurevic L, Erjavec I, Gupta M, Pecin M, Bordukalo-Niksic T, Stokovic N, Vnuk D, Farkas V, Capak H, Milosevic M, Bubic Spoljar J, Peric M, Vuckovic M, Maticic M, Windhager R, Oppermann H, T. Sampath K, Vukicevic V. Autologous blood coagulum containing rhBMP6 induces new bone formation to promote anterior lumbar interbody fusion (ALIF) and posterolateral lumbar fusion (PLF) of spine in sheep, Bone, 2020,138:115448, doi:10.1016/j.bone.2020.115448.
- Matijašić M, Meštrović T, Čipčić Paljetak H, Perić M, Barešić A, Verbanac D. Gut Microbiota beyond Bacteria-Mycobiome, Virome, Archaeome, and Eukaryotic Parasites in IBD. Int J Mol Sci. 2020 Apr 11;21(8):2668. doi: 10.3390/ijms21082668.
- Racané, L.; Ptiček, L.; Fajdetić, G.; Tralić-Kulenović, V.; Klobučar, M.; Kraljević Pavelić, S.; Perić, M.; Čipčić Paljetak, H.; Verbanac, D.; Starčević, K. Green synthesis and biological evaluation of 6-substituted-2-(2-hydroxy/methoxy phenyl)benzothiazole derivatives as potential antioxidant, antibacterial and antitumor agents. Bioorganic Chemistry 2020,95,103537. doi: 10.1016/j.bioorg.2019.103537
- Maslovara S, Butkovic-Soldo S, Peric M, Pajic Matic I, Sestak A. Effect of vestibular rehabilitation on recovery rate and functioning improvement in patients with chronic unilateral vestibular hypofunction and bilateral vestibular hypofunction, 2019, NeuroRehabilitation, 44 (1), 95-102. doi: 10.3233/NRE-182524.
- Stepanić V, Matijašić M, Horvat T, Verbanac D, Kučerová-Chlupáčová M, Sasso L, Žarković N. Antioxidant Activities of Alkyl Substituted Pyrazine Derivatives of Chalcones— In Vitro and In Silico Study. Antioxidants 2019, 8, 90; doi:10.3390/antiox8040090
- Grgurevic L, Oppermann H, Pecin M, Erjavec I, Capak H, Pauk M, Karlovic S, Kufner V, Lipar M, Bubic Spoljar J, Bordukalo-Niksic T, Maticic D, Peric M, Windhager R, Sampath TK, Vukicevic S. Recombinant Human Bone Morphogenetic Protein 6 Delivered Within Autologous Blood Coagulum Restores Critical Size Segmental Defects of Ulna in Rabbits. JBMR Plus. 2018 Nov 5;3(5):e10085. doi: 10.1002/jbm4.10085.
- Leskovar D, Meštrović T, Barešić A, Kraljević I, Panek M, Čipčić Paljetak H, Perić M, Matijašić M, Rogić D, Barišić A, Kelečić DL, Bender DV, Krznarić Ž, Verbanac D. The Role of Vitamin D in Inflammatory Bowel Disease - Assessing Therapeutic and Preventive Potential of Supplementation and Food Fortification. Food Tech Biotech 2018, 56(4), 455-463, DOI: 10.17113/ftb.56.04.18.5805
- Leskovar D, Kraljević I, Panek M, Kunović A, Meštrović T, Perić M, Čipčić Paljetak H, Matijašić M, Barešić A, Vranešić Bender D, Čuković Čavka S, Brinar M, Turk N, Crnčević Urek M, Kalauz M, Kufner V, Brajša K, Ergović G, Ljubas Kelečić D, Grgić D, Karas I, Rogić D, Banić M, Krznarić Ž, Verbanac D. Vitamin D u bolesnika sa sindromom iritabilnog crijeva- status i modulatorni čimbenici. Medix 2018 (God 24, Br 132)
- Gumerova NI, Al-Sayed E, Krivosudský L, Čipčić-Paljetak H, Verbanac D and Rompel A. Antibacterial Activity of Polyoxometalates Against Moraxella catarrhalis. Front. Chem. 2018 6:336. doi: 10.3389/fchem.2018.00336
- Dumic-Cule I, Peric M, Kucko L, Grgurevic L, Pecina M, Vukicevic S. Bone morphogenetic proteins in fracture repair. Int Orthop. 2018 Sep 15. doi: 10.1007/s00264-018-4153-y.
- Mašek T, Perin N, Racané L, Cindrić M, Čipčić Paljetak H, Perić M, Matijašić M, Verbanac D, Radić B, Šuran J, Starčević K. Chemical Composition, Antioxidant and Antibacterial Activity of Different Extracts of Poplar Type Propolis. Croat. Chem. Acta 2018, 91(1), 81–88 DOI: 10.5562/cca3298
- Panek M, Čipčić Paljetak H, Barešić A, Perić M, Matijašić M, Lojkić I, Vranešić Bender D, Krznarić Ž, and Verbanac D. Methodology challenges in studying human gut microbiota – effects of collection, storage, DNA extraction and next generation sequencing technologies. Sci Rep. 2018. DOI: 10.1038/s41598-018-23296-4
- Cindrić M, Perić M, Kralj M, Martin-Kleiner I, David-Cordonnier M-H, Čipčić Paljetak H, Matijašić M, Verbanac D, Karminski-Zamola G and Hranjec M. Antibacterial and antiproliferative activity of novel 2-benzimidazolyl- and 2-benzothiazolyl-substituted benzo[b]thieno-2-carboxamides. Mol Divers 2018. DOI: 10.1007/s11030-018-9822-7 22(3):637-646
- Grgurevic L, Erjavec I, Grgurevic I, Dumic-Cule I, Brkljacic J, Verbanac D, Matijasic M, Cipcic Paljetak H, Novak R, Plecko M, Bubic-Spoljar J, Rogic D, Kufner V, Pauk M, Bordukalo-Niksic T, Vukicevic S. Systemic inhibition of BMP1-3 decreases progression of CCl4-induced liver fibrosis in rats. Growth Factors. 2017 35(6):201-15. doi: 10.1080/08977194.2018.1428966.
- Perin N, Starčević K, Perić M, Čipčić Paljetak H, Matijašić M, Stepanić V, Verbanac D, Karminski-Zamola G, Hranjec M. Synthesis and SAR Study of Novel Amidino 2-substituted Benzimidazoles as Potential Antibacterial Agents. Croat. Chem. Acta 2017, 90(2) DOI: 10.5562/cca3147
- Verbanac D, Perić M, Matijašić M, Panek M, Meštrović T, Leskovar D, Kraljević I, Rogić D, Kunović A, Vranešić D, Krznarić Ž, Čipčić Paljetak H. Uloga i promjene mikrobiote u postmenopauzi. Medix 2017 (God 23, Br 126)
- Čipčić Paljetak, H.; Tomasković, L.; Matijasić, M.; Bukvić, M.; Fajdetić, A.; Verbanac, D.; Perić, M. Macrolide Hybrid Compounds: Drug Discovery Opportunities in Anti-Infective and Anti-Inflammatory Area. Curr. Top. Med. Chem., 2017, 17(8):919-940. doi: 10.2174/1568026616666160927160036
- Čipčić Paljetak, H., D. Verbanac, J. Padovan, M. Dominis-Kramarić, Ż. Kelnerić, M. Perić, M. Banjanac, G. Ergović, N. Simon, J. Broskey, D. J. Holmes, and V. Eraković Haber. 2016. Macrolones - novel class of macrolide antibiotics active against key resistant respiratory pathogens in vitro and in vivo. Antimicrob. Agents Chemother. 2016, 60(9):5337-48. doi: 10.1128/AAC.00524-16
- Verbanac D, Malik R, Chand M, Kushwaha K, Vashist M, Matijašić M, Stepanić V, Perić M, Čipčić Paljetak H, Saso L, Jain SC. Synthesis and evaluation of antibacterial and antioxidant activity of novel 2-phenyl-quinoline analogs derivatized at position 4 with aromatically substituted 4H-1,2,4-triazoles. J Enzyme Inhib Med Chem. 2016, doi: 10.1080/14756366.2016.1190714
- Matijašić M, Meštrović T, Perić M, Čipčić Paljetak H, Panek M, Vranešić Bender D, Ljubas Kelečić D, Krznarić Ž, Verbanac D. Modulating Composition and Metabolic Activity of the Gut Microbiota in IBD Patients. Int. J. Mol. Sci. 2016, 17, 578; doi:10.3390/ijms17040578
- Maračić S, Kraljević TG, Čipčić Paljetak H, Perić M, Matijašić M, Verbanac D, Cetina M, Raić-Malić S. 1,2,3-Triazole pharmacophore-based benzofused nitrogen/sulfur heterocycles with potential anti-Moraxella catarrhalis activity. Bioorg Med Chem. 2015 Dec 1;23(23):7448-63. doi: 10.1016/j.bmc.2015.10.042.
- Stolić I, Čipčić Paljetak H, Perić M, Matijašić M, Stepanić V, Verbanac D, Bajić M. Synthesis and structure–activity relationship of amidine derivatives of 3, 4-ethylenedioxythiophene as novel antibacterial agents. Eur J Med Chem. 90 (2015);68-81. doi: 10.1016/j.ejmech.2014.11.003.
- Peric M, Dumic-Cule I, Grcevic D, Matijasic M, Verbanac D, Paul R, Grgurevic L, Trkulja V, Bagi CM, Vukicevic S. The rational use of animal models in the evaluation of novel bone regenerative therapies. Bone 70 (2015) 73-86. doi: 10.1016/j.bone.2014.07.010.
- Vukicevic S, Oppermann H, Verbanac D, Jankolija M, Popek I, Curak J, Brkljacic J, Pauk M, Erjavec I, Francetic I, Dumic-Cule I, Jelic M, Durdevic D, Vlahovic T, Novak R, Kufner V, Bordukalo Niksic T, Kozlovic M, Banic Tomisic Z, Bubic-Spoljar J, Bastalic I, Vikic-Topic S, Peric M, Pecina M, Grgurevic L. The clinical use of bone morphogenetic proteins revisited: a novel biocompatible carrier device OSTEOGROW for bone healing. Int Orthop. 2014, 38(3):635-47. doi: 10.1007/s00264-013-2201-1.
- Donatella Verbanac, Mihaela Perić, Hana Čipčić-Paljetak, Mario Matijašić and Višnja Stepanić. Biologically active ingredients from food with anti-obesity properties; In: „Obesity: Public Health Problem and Medical Challenge“ - Proceedings of the symposium held on 8 May 2014 in Rijeka, (Ed.: D. Rukavina), Cro.Acad.Sci&Arts, Zagreb-Rijeka, 2014, p. 133-150
- Verbanac D, Perić M, Čipčić Paljetak H, Matijašić M, Sven Jurković. Prehrana i zdravlje respiratornog sustava. Medicus, 2013, 22(1):115-124.
- Tomaskovic, L., M. Komac, O. Makaruha Stegic, V. Munic, J. Ralic, B. Stanic, M. Banjanac, S. Markovic, B. Hrvacic, H. Cipcic Paljetak, J. Padovan, I. Glojnaric, V. Erakovic Haber, M. Mesic, and M. Mercep. Macrolactonolides: A novel class of anti-inflammatory compounds. Bioorganic and Medicinal Chemistry 2013, 21:321-332. doi: 10.1016/j.bmc.2012.10.036.
- Verbanac D, Stepanić V, Lučić B, Amić D, "The Must" of the Drug Discovery and Development is - Interdisciplinarity, Proceedings, New achievements of Croatian scientists in bioinformatics and biophysics, Croatian Academy of Arts and Science, V. Paar (Ed.) 2013, 179-189.
- Verbanac, Donatella; Stepanić, Višnja. Novi pogled na istraživanje lijekova – nove formulacije i kombinacije. Farmaceutski tehničar : stručno informativni časopis farmaceutskih tehničara Hrvatske. 63 (2013) ; 7-12
- Bosnar M, Kragol G, Koštrun S, Vujasinović I, Bošnjak B, Bencetić Mihaljević V, Marušić Ištuk Z, Kapić S, Hrvačić B, Brajša K, Tavčar B, Jelić D, Glojnarić I, Verbanac D, Čulić O, Padovan J, Alihodžić S, Eraković Haber V, Spaventi R. N’-Substituted-2’-O,3’-N-carbonimidoyl Bridged Macrolides: Novel Anti-inflammatory Macrolides without Antimicrobial Activity. J Med Chem, 2012, 55(13):6111-23. doi: 10.1021/jm300356u.
- Jelić D, Tatić I, Trzun M, Hrvačić B, Brajša K, Verbanac D, Tomašković M, Čulić O, Antolović R, Glojnarić I, Weygand-Đurašević I, Vladimir-Knežević S, Mildner B. Porphyrins as new endogenous anti-inflammatory agents. Eur J Pharmacol, 2012, 691(1-3):251-60. doi: 10.1016/j.ejphar.2012.05.049.
- Fistonić I , Šitum M, Bulat V, Harapin M, Fistoni, N, Verbanac D. Olive oil biophenols and women's health. Medicinski Glasnik, 2012, 9(1):1-9.
- Matijašić M, Munić Kos V, Nujić K, Cužić S, Padovan J, Kragol G, Alihodžić S, Mildner B, Verbanac D, Eraković Haber V. Fluorescently labeled macrolides as a tool for monitoring cellular and tissue distribution of azithromycin. Pharmacol Res, 2012, 66:332-342. doi: 10.1016/j.phrs.2012.06.001.
- Rubelj I, Stepanić V, Jelić D, Škrobot Vidaček N, Čukušić Kalajžić A, Ivanković M, Nujić K, Matijašić M, Verbanac D. Tebrophen – An Old Polyphenol Drug with Anticancer Potential. Molecules, 2012, 17(7):7864-7886. doi: 10.3390/molecules17077864.
- Starčević K, Pešić D, Toplak A, Landek G, Alihodžić S, Herreros E, Ferrer S, Spaventi R, Perić M. Novel hybrid molecules based on 15-membered azalide as potential antimalarial agents. Eur J Med Chem, 2012, 49:365-78. doi: 10.1016/j.ejmech.2012.01.039.
- Pešić D, Starčević K, Toplak A, Jelić D, Herreros E, Alihodžić S, Spaventi R, Perić M. Design, synthesis and in vitro activity of novel 2'-O-substituted-9-deoxo-9a-methyl-9a-aza-9a-homoerythromycin A derivatives. J Med Chem, 2012, 55(7):3216-27. doi: 10.1021/jm201676t.
- Verbanac D, Jain SC, Jain N, Chand M, Čipčić Paljetak H, Matijašić M, Perić M, Stepanić V, Sasso L. An efficient and convenient microwave-assisted chemical synthesis of (thio)xanthones with additional in vitro and in silico characterization. Bioorganic Med Chem, 2012, 20:3180-3185. doi: 10.1016/j.bmc.2012.03.074.
- I. Palej Jakopovic, M. Bukvic Krajacic, M. Matanovic Skugor, V. Stimac, D. Pesic, I. Vujasinovic, S. Alihodzic, H. Cipcic Paljetak, and G. Kragol, Novel desosamine-modified 14- and 15-membered macrolides without antibacterial activity, Bioorg. Med. Chem. Lett., 22 (2012) 3527-3530. doi: 10.1016/j.bmcl.2012.03.076.
- Ceric H, Sindler-Kulyk M, Kovacevic M, Peric M, Zivkovic A. Azetidinone-isothiazolidinones: stereoselective synthesis and antibacterial evaluation of new monocyclic beta-lactams. Bioorg Med Chem. 2010, 18(9): 3053-8. doi: 10.1016/j.bmc.2010.03.045.
- Bukvić Krajačić M, Perić M, Smith KS, Ivezić Schönfeld Z, Žiher D, Fajdetić A, Kujundžić N, Schönfeld W, Landek G, Padovan J, Jelić D, Ager A, Milhous WK, Ellis W, Spaventi R, Ohrt C. Synthesis, Structure-Activity Relationship, and Antimalarial Activity of Ureas and Thioureas of 15-Membered Azalides. J Med Chem, 2011, 54; 3595-3605. https://doi.org/10.1021/jm2001585
- Perić M, Fajdetić A, Rupčić R, Alihodžić S, Žiher D, Bukvić Krajačić M, Smith KS, Ivezić-Schönfeld Z, Padovan J, Landek G, Jelić D, Hutinec A, Mesić M, Ager A, Ellis W, Milhous W, Ohrt C, Spaventi R. Antimalarial Activity of 9a-N Substituted 15-Membered Azalides with Improved In Vitro and In Vivo Activity over Azithromycin. J Med Chem, 2011. doi: 10.1021/jm201615t.
- Munić V, Banjanac M, Koštrun S, Nujić K, Bosnar M, Marjanović N, Ralić J, Matijašić M, Hlevnjak M, Eraković-Haber V. Intensity of macrolide anti-inflammatory activity in J774A.1 cells positively correlates with cellular accumulation and phospholipidosis. Pharmacol Res. 2011, 64(3): 298-307. doi: 10.1016/j.phrs.2011.03.011.
- Parish J, Perić M, Čipčić-Paljetak H, Matijašić M, Verbanac D. Translating the Mediterranean diet. Period Biol. 2011, 113(3): 303-10.
- Perić M, Čipčić Paljetak H, Matijašić M, Verbanac D. Debljina, mikrobiote i imunomodulacija. Infektol Glasn, 2011, 31(1): 49-58.
- Verbanac, D. Mediterranean diet - Does it work? Does it exist? Kidney and blood pressure research. 2010, 35(6): 436
- Verbanac, D. Predictive methods as a powerful tool in drug discovery. Biochemia medica. 2010, 3; 314-318.
- Palej Jakopovic, I., G. Kragol, A. K. Forrest, C. S. V. Frydrych, V. Stimac, S. Kapic, M. Matanovic Skugor, M. Ilijas, H. Cipcic Paljetak, D. Jelic, D. J. Holmes, D. M. B. Hickey, D. Verbanac, V. Erakovic Haber, and S. Alihodzic. Synthesis and properties of macrolones characterized by two ether bonds in the linker. Bioorganic & Medicinal Chemistry. 2010, 18: 6578-6588. doi: 10.1016/j.bmc.2010.07.007.
- Fajdetic, A., A. Vinter, H. Cipcic Paljetak, J. Padovan, I. Palej Jakopovic, S. Kapic, S. Alihodzic, D. Filic, M. Modric, N. Kosutic-Hulita, R. Antolovic, Z. Ivezic Schoenfeld, S. Mutak, V. Erakovic Haber, and R. Spaventi. Synthesis, activity and pharmacokinetics of novel antibacterial 15-membered ring macrolones. European Journal of Medicinal Chemistry 2011, 46 :3388-3397. https://doi.org/10.1016/j.ejmech.2011.05.002
- Leljak-Levanić, D., H. Čipčić Paljetak, L. Uzelac, S. Mihaljević, N. Bauer, M. Krsnik-Rasol, and S. Jelaska. Extracellular Glycoproteins in Embryogenic Culture of Pumpkin (Cucurbita pepo L.). Food Technology and Biotechnology 2011, 49: 156-161.
- Kapic, S., H. Cipcic Paljetak, I. Palej Jakopovic, A. Fajdetic, M. Ilijas, V. Stimac, K. Brajsa, D. J. Holmes, J. Berge, and S. Alihodzic. Synthesis of macrolones with central piperazine ring in the linker and its influence on antibacterial activity. Bioorganic & Medicinal Chemistry. 2011. 19(23): 7281. doi: 10.1016/j.bmc.2011.07.010.
- Kapic, S., A. Fajdetic, S. Kostrun, A. Cikos, H. Cipcic Paljetak, R. Antolovic, D. J. Holmes, and S. Alihodzic. Synthesis and Activity of New Macrolones: Conjugates Between 6(7)-(2'-Aminoethyl)-amino-1-cyclopropyl-3-carboxylic acid (2'-hydroxyethyl) amides and 4''-Propenoyl-azithromycin. Bioorganic & Medicinal Chemistry. 2011. 19(23): 7270. doi: 10.1016/j.bmc.2011.07.011.
- Fajdetic, A., H. Cipcic Paljetak, G. Lazarevski, A. Hutinec, S. Alihodzic, M. Djerek, V. Stimac, D. Andreotti, V. Sunjic, J. M. Berge, S. Mutak, M. Dumic, S. Lociuro, D. J. Holmes, N. Marsic, V. Erakovic Haber, and R. Spaventi. 4''-O-([omega]-Quinolylamino-alkylamino)propionyl derivatives of selected macrolides with the activity against the key erythromycin resistant respiratory pathogens. Bioorganic & Medicinal Chemistry 2010, 18; 6559-6568. doi: 10.1016/j.bmc.2010.06.049.
- Kapic, S., H. Cipcic Paljetak, S. Alihodzic, R. Antolovic, V. Erakovic Haber, R. L. Jarvest, D. J. Holmes, J. P. Broskey, and E. Hunt. 6-Alkylquinolone-3-carboxylic acid tethered to macrolides synthesis and antimicrobial profile. Bioorganic & Medicinal Chemistry 2010, 18; 6569-6577. doi: 10.1016/j.bmc.2010.06.048.
- Matanovic Skugor, M., V. Stimac, I. Palej, D. Lugaric, H. Cipcic Paljetak, D. Filic, M. Modric, I. Djilovic, D. Gembarovski, S. Mutak, V. Erakovic Haber, D. J. Holmes, Z. Ivezic-Schoenfeld, and S. Alihodzic. Synthesis and biological activity of 4''-O-acyl derivatives of 14- and 15-membered macrolides linked to [omega]-quinolone-carboxylic unit. Bioorganic & Medicinal Chemistry 2010, 18: 6547-6558. doi: 10.1016/j.bmc.2010.06.050.
- Hutinec, A., M. Djerek, G. Lazarevski, V. Sunjic, H. Cipcic Paljetak, S. Alihodzic, V. Erakovic Haber, M. Dumic, N. Marsic, and S. Mutak. 2010. Novel 8a-aza-8a-homoerythromycin--4''-(3-substituted-amino) propionates with broad spectrum antibacterial activity. Bioorganic & Medicinal Chemistry Letters 20:3244-3249. doi: 10.1016/j.bmcl.2010.04.062.
- Jelić D, Nujić K, Stepanić V, Kovačević K, Verbanac D. 6-Imino-2-thioxo-pyrimidinones as a new class of dipeptidyl peptidase IV inhibitors. Medicinal chemistry research. 2011, 3; 339-345. DOI: 10.1007/s00044-010-9314-5
Odjel za proteomiku
- Novak, R., Salai, G., Hrkac, S., Kovacevic Vojtusek, I. and Grgurevic, L. Revisiting the Role of NAG Across the Continuum of Kidney Disease. (2023) Bioengineering, 10,444. https://doi.org/10.3390/ bioengineering10040444
- Grgurevic, L., Novak, R., Salai, G., Hrkac, S., Mocibob, M., Kovacevic Vojtusek, I., Laganovic, M. Stage II of Chronic Kidney Disease—A Tipping Point in Disease Progression? (2022) Biomedicines. 2022, 10, 1522. https://doi.org/10.3390/biomedicines10071522
- Grgurevic, L., Novak, R., Salai, G., Hrkac, S., Mocibob, M., Kovacevic Vojtusek, I., Laganovic, M. Stage II of Chronic Kidney Disease—A Tipping Point in Disease Progression? (2022) Biomedicines. 2022, 10, 1522.¸ https://doi.org/10.3390/biomedicines10071522
- Kovacevic Vojtusek, I., Laganović, M., Burek Kamenaric, M., Bulimbasic, S., Hrkac, S., Salai, G., Ivkovic, V., Coric, M., Novak, R., Grgurevic, L. First characterization of ADAMTS-4 in kidney tissue and plasma of patients with chronic kidney disease - a potential novel diagnostic indicator. (2022) Diagnostics. 12, 648. https://doi.org/10.3390/diagnostics12030648
- Hrkac, S., Novak, R., Salai, G., Grazio, S., Vlahovic, T., Grgurevic, L. Heterotopic ossification vs. fracture healing: Extracellular vesicle cargo proteins shed new light on bone formation. (2022) Bone reports. 2022. doi: 10.1016/j.bonr.2022.101177
- Hrkac S, Novak R, Salai G, Grazio S,Vlahovic T, Grgurevic L. Different cytokine expression profiles in metaphyseal and diaphyseal fracture healing may provide new insights in the field of bone regeneration RAD CASA - Medical Sciences. 552=58-59 (2022): 10-19 DOI: 10.21857/y6zolb6vzm
- Salai G, Bilic E, Primorac D, Mahovic Lakusic D, Bilic H, Lazibat I, Grgurević L. Benign Fasciculation Syndrome and Migraine Aura without Headache: Possible Rare Side Effects of the BNT162b2 mRNA Vaccine? A Case Report and a Potential Hypothesis. Vaccines. 2022; 10(1):117. https://doi.org/10.3390/vaccines10010117
- BMP3 Affects Cortical and Trabecular Long Bone Development in Mice. Ivan Banovac, Lovorka Grgurevic, Viktorija Rumenovic, Slobodan Vukicevic, Igor Erjavec. Int. J. Mol. Sci. 2022, 23, 785. https://doi.org/10.3390/ijms23020785
- Novak, R., Hrkac, S., Salai, G., Bilandzic, J., Mitar, L., Grgurevic, L. The role of ADAMTS-4 in atherosclerosis and vessel wall abnormalities. (2022), JVR. https://doi.org/10.1159/000521498
- Fabris, D., Karmelić, I., Muharemović, H., Sajko, T., Jurilj, M., Potočki, S., Novak, R., Vukelić, Ž. Ganglioside Composition Distinguishes Anaplastic Ganglioglioma Tumor Tissue from Peritumoral Brain Tissue: Complementary Mass Spectrometry and Thin-layer Chromatography Evidence. (2021), IJMS. 2021, 22, 8844. https://doi.org/10.3390/ijms22168844
- Simeon Grazio , Vanja Bašić Kes , Dijana Zadravec , Karlo Houra , Lovorka Grgurević , Tomislav Nemčić , Ivan Mikula , Marijana Lisak , Branka Aukst Margetić , Diana Balen , Vide Bilić , Boris Božić , Stipe Ćorluka , Frane Grubišić , Neven Ištvanović, Dalibor Karlović , Neven Kauzlarić, Dražen Kvesić, Darko Ledić, Petra Margetić , Tatjana Nikolić , Darko Perović, Dubravka Sajković , Tea Schnurrer Luke Vrbanić, Hana Skala Kavanagh , Ivan Škoro , Tonko Vlak, Ana Poljičanin, Krešimir Rotim. Smjernice za dijagnostiku i liječenje bolesnika s vratoboljom – 1. dio Guidelines for diagnosis and treatment of patients with neck pain – Part 1. Liječ Vjesn 2021;143:143–162 https://doi.org/10.26800/LV-143-5-6-1
- Simeon Grazio1, Darko Perović , Hana Skala Kavanagh , Tonko Vlak , Tea Schnurrer Luke Vrbanić , Frane Grubišić , Boris Božić , Neven Kauzlarić , Vide Bilić , Dalibor Karlović , Darko Ledić , Tatjana Nikolić , Ana Poljičanin , Branka Aukst Margetić , Dražen Kvesić, Ivan Škoro , Neven Ištvanović , Dubravka Sajković , Stipe Ćorluka , Diana Balen , Vanja Bašić Kes, Lovorka Grgurević, Karlo Houra, Marijana Lisak, Petra Margetić, Ivan Mikula, Tomislav Nemčić , Dijana Zadravec, Krešimir Rotim. Smjernice za dijagnostiku i liječenje bolesnika s vratoboljom – 2. dio Guidelines for diagnosis and treatment of patients with neck pain – Part 2. Liječ Vjesn 2021;143:327–348 https://doi.org/10.26800/LV-143-9-10-1
- Grgurevic, L., Novak, R., Hrkac, S., Salai, G., Grazio, S. Post-COVID-19 exacerbation of fibrodysplasia ossificans progressiva with multiple flare-ups and extensive heterotopic ossification in 45-year old woman. (2021) Rheumatology International 41(8), 1495-1501. http://10.1007/s00296-021-04911-6.
- Grgurevic, L., Novak, R., Salai, G., Trkulja, V., Ferhatovic Hamzic, L., Zgombic Popovic, V., Bozic, D. Identification of bone morphogenetic protein 4 in saliva after placement of fixed orthodontic appliance. (2021) Progress in Orthodontics 22:19. doi: 10.1186/s40510-021-00364-6
- Salai, G., Zelenika, M., Hrhač, S., Trkulja, V., Bilandžić, J., Grgurević, J., Novak, R. and Grgurević, L. Plasma levels of soluble TGF β receptor type III: no apparent promise as a marker in acute pancreatitis. CMJ (2021); 62:264-9. https://doi.org/10.3325/cmj.2021.62.26
- Grazio, S., Grgurević, L., Perović, D., Schnurrer, T., Vrbanić, L., Kovač, Z., Božić, B., Houra, K., Borić, I., Kvesić, D., Novak, R., Ferhatović Hamzić, L., Grubišić, F., Sajko, T., Saftić, R., Dokuzović, S., Rotim, K. (2021) Novosti u etiopatogenezi, dijagnostici i liječenju bolesnika s degenerativnim promjenama intervertebralnog diska slabinskog dijela kralježnice. Liječ Vjesn 2021;143:63–77. https://doi.org/10.26800/LV-143-1-2-9
- Grgurevic, L., Novak, R., Trkulja, V., Hrkac, S., Salai, G., Bilandzic, J., Ferhatovic Hamzic, L., Milas, I., Vucemilo, T., Peric Balja, M. and Bilic. K. Plasma levels and tissue expression of soluble TGFβrIII receptor in women with early‑stage breast cancer and in healthy women: a prospective observational study. J Transl Med (2020) 18:478. https://doi.org/10.1186/s12967-020-02659-4
- Zgombić Popović, V., Grgurević, L., Trkulja, V., Novak, R. and Negovetić-Vranić, D. The role of new technologies in defining salivary protein composition following placement of fixed orthodontic appliances – breakthrough in the development of novel diagnostic and therapeutic procedures. Acta Clin Croat (2020); 59:1-9. https://doi.org/10.20471/acc.2020.59.03.12
- Vukičević S., Perić M., Oppermann H., Štoković N., Ivanjko N., Erjavec I., Kufner V., Vnuk D., Bubić-Špoljar J., Pećin M., Novak R., Matić Jelić I., Bakić K., Milešević M., Rumenović V., Popek I., Pehar S., Martinović S., Blažević V., Rogina L., Vikić-Topić S., Božić T., Verbanac D., Bordukalo Nikšić T., Sampath K., Pećina M., Matičić D., Grgurević L. (2020) Bone morphogenetic proteins: From discovery to development of a novel autologous bone graft substitute consisting of recombinant human BMP6 delivered in autologous blood coagulum carrier. RAD 544. Medical Sciences 52-53 (2020) : 26-41.
- Grgurević L. i Novak R. (2020) Identifikacija markera za osteoporozu – molekularna dilema. Fizikalna i rehabilitacijska medicina. 34(3-4):97-164.
- Murgic J, Grgurevic L, Grazio S, Vukojevic R, Hoxha N, Maric-Brozic J, Soldic Z, Zovak M , Fröbe A. In Regard to Lee et al. Int J Radiat Oncol Biol Phys. 2020 105(5):1392-1394. doi: 10.1016/j.ijrobp.2020.07.016
- Grgurevic L, Erjavec I, Gupta M, Pecin M, Bordukalo-Niksic T, Stokovic N, Vnuk D, Farkas V, Capak H, Milosevic M, Bubic Spoljar J, Peric M, Vuckovic M, Maticic D, Windhager R, Oppermann H, Sampath TK, Vukicevic S.Autologous blood coagulum containing rhBMP6 induces new bone formation to promote anterior lumbar interbody fusion (ALIF) and posterolateral lumbar fusion (PLF) of spine in sheep. Bone. 2020 Sep;138:115448. doi: 10.1016/j.bone.2020.115448.
- Chiari C, Grgurevic L, Bordukalo-Niksic T, Oppermann H, Valentinitsch A, Nemecek E, Staats K, Schreiner M, Trost C, Kolb A, Kainberger F, Pehar S, Milosevic M, Martinovic S, Peric M, Sampath TK, Vukicevic S, Windhager R.Chiari C, et al. Recombinant Human BMP6 Applied Within Autologous Blood Coagulum Accelerates Bone Healing: Randomized Controlled Trial in High Tibial Osteotomy Patients. J Bone Miner Res. 2020 Jun 16. doi: 10.1002/jbmr.4107.
- Durdevic D, Vlahovic T, Pehar S, Miklic D, Oppermann H, Bordukalo-Niksic T, Gavrankapetanovic I, Jamakosmanovic M, Milosevic M, Martinovic S, Sampath TK, Peric M, Grgurevic L, Vukicevic S. A novel autologous bone graft substitute comprised of rhBMP6 blood coagulum as carrier tested in a randomized and controlled Phase I trial in patients with distal radial fractures. Bone. 2020 Nov;140:115551. doi: 10.1016/j.bone.2020.115551.
- Grgurević, L., Novak, R., Trkulja, V., Ferhatović Hamzić, L., Hrkač, S., Grazio, S., Santini, M. Elevated plasma RANTES in fibrodysplasia ossificans progressiva – A novel therapeutic target? Medical Hypotheses, 131 (2019) 109313. doi: 10.1016/j.mehy.2019.109313
- Košec, A.#, Novak, R.#, Konjevoda, P., Trkulja, V., Bedeković, V. and Grgurević, L. Tumor tissue hnRNP M and HSP 90α as potential predictors of disease-specific mortality in patients with early-stage cutaneous head and neck melanoma: a proteomics-based study. Oncotarget, (2019). 10:6713-6722. #Jednak doprinos autora. https://doi.org/10.18632/oncotarget.27333
- Vukicevic S, Grgurevic L, Erjavec I, Pecin M, Bordukalo-Niksic T, Stokovic N, Lipar M, Capak H, Maticic D, Windhager R, Sampath TK, Gupta M. Autologous blood coagulum is a physiological carrier for BMP6 to induce new bone formation and promote posterolateral lumbar spine fusion in rabbits. J Tissue Eng Regen Med. 2019 Oct 31. doi: 10.1002/term.2981
- V Farkaš, L Grgurević ; Bone morphogenetic proteins in a rabbit posterolateral spinal fusion model: an overview. Veterinarska stanica, Vol. 50 No. 4, 2019
- Pauk M, Bordukalo‑Niksic T, Brkljacic J, Paralkar VM, Brault AL, Dumic‑Cule I, Borovecki F, Grgurevic L, Vukicevic S: A novel role of bone morphogenetic protein 6 (BMP6) in glucose homeostasis. Acta Diabetol. 2019 Mar;56(3):365-371. doi: 10.1007/s00592-018-1265-1.
- Grgurevic L, Vukicevic S: OSTEOGROW – novel bone device for bone regeneration. Medical Sciences, Rad 533, 2018
- Vučinić N, Erić M, Grgurević L, Dumić-Čule I, Tičinović N. PALMARIS LONGUS ABSENT IN ONE IDENTICAL TWIN: A CASE REPORT. Acta Clin Croat. 2018 Dec;57(4):772-775. doi: 10.20471/acc.2018.57.04.21.
- Grgurevic L, Oppermann H, Pecin M, Erjavec I, Capak H, Pauk M, Karlovic S, Kufner V, Lipar M, Bubic Spoljar J, Bordukalo-Niksic T, Maticic D, Peric M, Windhager R, Sampath TK, Vukicevic S. Recombinant Human Bone Morphogenetic Protein 6 Delivered Within Autologous Blood Coagulum Restores Critical Size Segmental Defects of Ulna in Rabbits. JBMR Plus. 2018 Nov 5;3(5):e10085. doi: 10.1002/jbm4.10085.
- Suton P, Bolanca A, Grgurevic L, Erjavec I, Nikles I, Muller D, Manojlovic S, Vukicevic S, Petrovecki M, Dokuzovic S, Luksic I: Prognostic significance of bone morphogenetic protein 6 (BMP6) expression, clinical and pathological factors in clinically node-negative oral squamous cell carcinoma (OSCC). J Craniomaxillofac Surg 2018. doi: 10.1016/j.jcms.2018.10.003.
- Dumic-Cule I, Peric M, Kucko L, Grgurevic L, Pecina M, Vukicevic S.: Bone morphogenetic proteins in fracture repair. Int Orthop. 42(11):2619-2626, 2018. doi: 10.1007/s00264-018-4153-y.
- Vukicevic S, Kusic Z, Grgurevic L: Science communication to the public. Croat Med J. 30;59(2):43-45, 2018. doi: 10.3325/cmj.2018.59.43.
- Štoković N, Trkulja V, Čuković-Bagić I, Lauc T, Grgurević L.: Anatomical variations of the frontal sinus and its relationship with the orbital cavity. Clinical Anatomy, 31(4):576-582, 2018. doi: 10.1002/ca.22999.
- Somborac-Bačura, A., Rumora, L., Novak, R., Rašić, D., Dumić, J., Čepelak, I. and Žanić-Grubišić, T. Differential expression of HSPs and activation of MAPKs in A549 alveolar epithelial cells exposed to cigarette smoke extract. Experimental Physiology, 2018 Dec;103(12):1666-1678. doi: 10.1113/EP087038.
- Grazio S, Bašić Kes V, Grgurević L, Božić B, Perović D, Zadravec D, Grubišić F, Kvesić D, Mikula I, Nemčić T, Borić I, Houra K, Mustapić M, Nikolić T, Lisak M, Dumić-Čule I, Vukojević R, Koprek I, Brnić V, Rotim K. Stenoza spinalnog kanala slabinske kralježnice – od epidemiologije do rehabilitacije. Liječ Vijesn 2018; 140:34-49. https://doi.org/10.26800/LV-140-1-2-5
- Grgurevic, L., Erjavec, I., Grgurevic, I., Dumic-Cule, I., Brkljacic, J., Verbanac, D., Matijasic, M., Cipcic Paljetak, H., Novak, R., Plecko, M., Bubic-Spoljar, J., Rogic, D., Kufner, V., Pauk, M., Bordukalo-Niksic, T., Vukicevic, S. Systemic inhibition of BMP1-3 decreases progression of CCl4-induced liver fibrosis in rats. Growth Factors, 2017 Dec;35(6):201-215. doi: 10.1080/08977194.2018.1428966
- Mokos ZB, Jovic A, Grgurevic L, Dumic-Cule I, Kostovic K, Ceovic R, Marinovic B. Current Therapeutic Approach to Hypertrophic Scars. Front Med (Lausanne), 20;4:83, 2017. doi: 10.3389/fmed.2017.00083.
- Grgurevic L, Dumic-Cule I, Vukicevic S: BMPs in Inflammation. In: Bone Morphogenetic Proteins: System Biology Regulators (Editors: Vukicevic S, Sampath KT), Springer International Publishing AG, 2017. https://doi.org/10.1007/978-3-319-47507-3
- Sampath KT, Grgurevic L, Vukicevic S: Bone Morphogenetic Protein-7 and Its Role in Acute Kidney Injury and Chronic Kidney Failure. In: Bone Morphogenetic Proteins: System Biology Regulators (Editors: Vukicevic S, Sampath KT), Springer International Publishing AG, 2017. DOI: 10.1007/978-3-319-47507-3_12
- Grgurevic L, Erjavec I, Dumic-Cule I, Bordukalo-Niksic T, Pauk M, Trkulja V, Maticic D, Pecin M, Lipar M, Peric M, Vukicevic S: Osteogrow: A Novel Bone Graft Substitute for Orthopedic. In: Bone Morphogenetic Proteins: System Biology Regulators (Editors: Vukicevic S, Sampath KT), Springer International Publishing AG, 2017. DOI: 10.1007/978-3-319-47507-3_12
- Grgurevic L, Pecina M, Vukicevic S: Marshall R. Urist and the discovery of bone morphogenetic proteins. International Orthopaedics 41:1065-1069, 2017. doi: 10.1007/s00264-017-3402-9.
- Grgurević L. Funkcionalna i topografska anatomija vratne kralježnice. Zbornik sažetaka sa simpozija „Smjernice za dijagnostiku i liječenje bolesnika s vratoboljom“. Fiz. rehabil. med. 2017;30(3-4):123-163
- Grgurevic L. Osteogrow Development: Bmp6 Bone Device For Enhancing Bone Healing. Clinical Therapeutics 6;38(10S):e9-e10, 2016. doi: 10.1016/j.clinthera.2016.07.106.
- Grgurevic L, Dumic-Čule I, Vukicevic S. Osteogrow-nova terapija za koštanu regeneraciju.Fiz.rehabil.med.2016;28:102-110
- Erjavec I, Bordukalo-Niksic T, Brkljacic J, Grcevic D, Mokrovic G, Kesic M, Rogic D, Zavadoski W, Paralkar VM, Grgurevic L, Trkulja V, Cicin-Sain L, Vukicevic S: Constitutively Elevated Blood Serotonin Is Associated with Bone Loss and Type 2 Diabetes in Rats. PLoS One 23;11(2):e0150102, 2016. doi: 10.1371/journal.pone.0150102.
- Grgurević L, Christensen GL, Schulz T, Vukicevic S: Bone morphogenetic proteins in inflammation, glucose homeostasis and adipose tissue energy metabolism. Cytokine and Growth Factor Reviews 27:205-118, 2016. doi: 10.1016/j.cytogfr.2015.12.009.
- Stokovic N, Trkulja V, Dumic-Cule I, Cukovic-Bagic I, Lauc T, Vukicevic S, Grgurevic L. Sphenoid sinus types, dimensions and relationship with surrounding structures. Annals of Anatomy 203:69-76, 2016. doi: 10.1016/j.aanat.2015.02.013.
- Pauk, Martina; Grgurević, Lovorka; Brkljačić, Jelena; Kufner, Vera; Bordukalo-Nikšić, Tatjana; Grabušić, Kristina; Razdorov, Genadij; Rogić, Dunja; Zuvić, Marijan; Oppermann, Hermann et al. Exogenous BMP7 corrects plasma iron overload and bone loss in Bmp6-/- mice // International orthopaedics,39 (2015), 1; 161-172. doi:10.1007/s00264-014-2550-4
- Badovinac, Ana; Razdorov, Genadij; Grgurević, Lovorka; Puhar, Ivan; Plančak, Darije; Božić, Darko. Primjena tehnologije LC-MS/MS za proteomsku analizu gingivnog tkiva: eksperimentalno istraživanje // Acta stomatologica Croatica,47 (2013), 1; 10-20. https://doi.org/10.15644/asc47/1/2
- Grazio, Simeon; Razdorov, Genadij; Erjavec, Igor; Grubišić, Frane; Kusić, Zvonko; Punda, Marija; Antičević, Darko; Vukičević, Slobodan; Grgurević, Lovorka. Differential expression of proteins with heparin affinity in patients with rheumatoid and psoriatic arthritis– a preliminary study // Clinical and experimental rheumatology,31 (2013), 5; 665-671.
- Božić, Darko; Grgurević, Lovorka; Erjavec, Igor; Brkljačić, Jelena; Orlić, Iva; Razdorov, Genadij; Grgurević, Ivica; Vukičević, Slobodan; Plančak, Darije. The proteome and gene expression profile of cementoblastic cells treated by bone morphogenetic protein-7 in vitro // Journal of clinical periodontology, 39 (2012), 1; 80-90 doi:10.1111/j.1600-051X.2011.01794.x
- Božić, Darko; Grgurević, Lovorka; Erjavec, Igor; Razdorov, Genadij; Brkljačić, Jelena; Orlić, Iva; Plančak, Darije. Effect of Bone Morphogenetic Protein-7 on Gene Expression of Bone Morphogenetic Protein-4, Dentin Matrix Protein-1, Insulin-like Growth Factor-I and –II in Cementoblasts In Vitro // Collegium antropologicum,36 (2012), 4; 1265-1271.
Laboratorij za mineralizirana tkiva
- Stokovic N, Ivanjko N, Milesevic M, Sampath TK, Vukicevic S. A simple rodent subcutaneous assay for identification of new osteoinductive molecules: The key method for screening of novel bone regeneration implants. RAD CASA. Medical Sciences 553 (60-61): 40-53, 2022. doi: 10.21857/y54jofvgxm
- Stokovic N, Ivanjko N, Matic Jelic I, Milesevic M, Rumenovic V, Blazevic V, Rogina L, Bastalic I, Erjavec I, Bordukalo-Niksic T, Kufner V, Adanic D, Peric M, Pecina M, Sampath TK, Vukicevic S. State-of-the-art of the Bone Morphogenetic Protein research field: 13th International BMP Conference, Dubrovnik 2022. RAD CASA. Medical Sciences 553 (60-61): 84-99, 2022. doi: 10.21857/ypn4ocd309
- Stokovic N, Ivanjko N, Pecin M, Erjavec I, Smajlović A, Milesevic M, Karlovic S, Capak H, Vrbanac Z, Maticic D, Vukicevic S. Long-term posterolateral spinal fusion in rabbits induced by rhBMP6 applied in autologous blood coagulum with synthetic ceramics. Scientific Reports 12:11649, 2022. doi: 10.1038/s41598-022-14931-2.
- Stokovic N, Ivanjko N, Rumenovic V, Breski A, Sampath KT, Peric M, Pecina M, Vukicevic S. Comparison of synthetic ceramic products formulated with autologous blood coagulum containing rhBMP6 for induction of bone formation. Int Orthop.46:2693-2704, 2022. doi: 10.1007/s00264-022-05546-3
- Bordukalo-Niksic T, Kufner V, Vukicevic S. The Role of BMPs in the regulation of osteoclasts resorption and bone remodeling: From experimental models to clinical applications. Frontiers in Immunology 13:869422, 2022. doi: 10.3389/fimmu.2022.869422
- Vukicevic S, Colliva A, Kufner V, Martinelli V, Moimas S, Vodret S, Rumenovic V, Milosevic M, Brkljacic B, Delic-Brkljacic D, Correa R, Giacca M, Maglione M, Bordukalo-Niksic T, Dumic-Cule I, Zacchigna S. Bone Morphogenetic Protein 1.3 inhibition decreases scar formation and supports cardiomyocyte survival after myocardial infarction. Nature Communications 13:81, 2022. doi: 10.1038/s41467-021-27622-9.
- Marino S, Hannemann N, Bishop RT., Zeng F, Carrasco G, Meurisse S, Li B, Sophocleous A, Sparatore A, Baeuerle T, Vukicevic S, Auberval M, Mollat P, Bozec A, Idris AI. Anti-inflammatory, but not osteoprotective, effect of the TRAF6/CD40 inhibitor 6877002 in rodent models of local and systemic osteolysis. Biochemical Pharmacology 195:114869, 2022. doi: 10.1016/j.bcp.2021.114869
- Banovac I, Grgurevic L, Rumenovic V, Vukicevic S, Erjavec I. BMP3 affects cortical and trabecular long bone development in mice International Journal of Molecular Sciences 23:785, 2022. doi: 10.3390/ijms23020785
- Bordukalo-Niksic T, Kufner V. BMP1.3 protein as potential target in treatment of fibrosis. RAD CASA - Medical Sciences 548:56-69, 2021. doi: : 10.21857/y7v64t0oxy
- Pecin M, Stokovic, N, Ivanjko N, Smajlovic A, Kreszinger M, Capak H, Vrbanac Z, Oppermann H, Maticic D, Vukicevic S. A novel autologous bone graft substitute containing rhBMP6 in autologous blood coagulum with synthetic ceramics for reconstruction of a large humerus segmental gunshot defect in a dog: The first veterinary patient to receive a novel osteoinductive therapy. Bone Reports 14:100759, 2021. doi: 10.1016/j.bonr.2021.100759
- Štoković N, Ivanjko N, Milešević M, Matić Jelić I, Bakić K, Rumenović V, Oppermann H, Shimp L, Sampath TK, Pećina M, Vukičević S. Synthetic ceramic macroporous blocks as a scaffold in ectopic bone formation induced by recombinant human bone morphogenetic protein 6 within autologous blood coagulum in rats. International Orthopaedics 45(4):1097-1107, 2021, doi: 10.1007/s00264-020-04847-9
- Stokovic N, Ivanjko N, Maticic D, Luyten FP, Vukicevic S. Bone Morphogenetic Proteins, carriers and animal models in the development of novel bone regenerative therapies. Materials 14:3513, 2021. doi: 10.3390/ma14133513
- Stokovic N, Ivanjko N, Erjavec I, Breski A, Peric M, Vukicevic S. Zoledronate Bound to Ceramics Increases Ectopic Bone Volume Induced by rhBMP6 Delivered in Autologous Blood Coagulum in Rats. Biomedicines 9:1487, 2021. doi: 10.3390/biomedicines9101487
- Pauk M, Kufner V, Rumenović V, Dumić-Čule I, Farkaš V, Milošević M, Bordukalo-Nikšić T, Vukičević S. Iron overload in aging Bmp6(-/-) mice induces exocrine pancreatic injury and fibrosis due to acinar cell loss. International Journal of Molecular Medicine 47(4):1-8, 2021, doi: 10.3892/ijmm.2021.4893
- Lammens J, Maréchal M, Delport H, Geris L, Oppermann H, Vukicevic S, Luyten FP. A cell-based combination product for the repair of large bone defects. Bone 138:115511, 2020. doi: 10.1016/j.bone.2020.115511
- Vukicevic S, Peric M, Oppermann H, Stokovic N, Ivanjko N, Erjavec I, Kufner V, Vnuk D, Bubic-Spoljar J, Pecin M, Novak R, Matic Jelic I, Bakic K, Milesevic M, Rumenovic V, Popek I, Pehar S, Martinovic S, Blazevic V, Rogina L, Vikic-Topic S, Bozic T, Verbanac D, Bordukalo Niksic T, Sampath TK, Pecina M, Maticic D, Grgurevic L. Bone morphogenetic proteins: From discovery to development of a novel autologous bone graft substitute consisting of recombinant human BMP6 delivered in autologous blood coagulum carrier. RAD CASA - Medical Sciences 544:26-41, 2020. doi: https://dx.doi.org/10.21857/mnlqgc5vgy
- Štoković N, Ivanjko N, Erjavec I, Milošević M, Oppermann H, Shimp L, Sampath KT, Vukičević S. Autologous bone graft substitute containing rhBMP6 within autologous blood coagulum and synthetic ceramics of different particle size determines the quantity and structural pattern of bone formed in a rat subcutaneous assay. Bone 141, 2020, doi: 10.1016/jbone.2020.115654
- Sampath TK, Vukičević S. Biology of bone morphogenetic protein in bone repair and regeneration: A role for autologous blood coagulum as carrier. Bone 141, 2020, doi: 10.1016/j.bone.2020.115602
- Đurđević D, Vlahović T, Pehar S, Miklić D, Oppermann H, Bordukalo-Nikšić T, Gavrankapetanović I, Jamakosmanović M, Milošević M, Martinović S, Sampath TK, Perić M, Grgurević L, Vukičević S. A novel autologous bone graft substitute comprised of rhBMP6 blood coagulum as carrier tested in a randomized and controlled Phase I trial in patients with distal radial fractures. Bone 140, 2020, doi: 10.1016/j.bone.2020.115551
- Štoković N, Ivanjko N, Pećin M, Erjavec I, Karlović S, Smajlović A, Capak H, Milošević M, Bubić Špoljar J, Vnuk D, Matičić D, Oppermann H, Sampath TK, Vukičević S. Evaluation of synthetic ceramics as compression resistant matrix to promote osteogenesis of autologous blood coagulum containing recombinant human bone morphogenetic protein 6 in rabbit posterolateral lumbar fusion model. Bone 140, 2020, doi: 10.1016/j.bone.2020.115544
- Grgurević L, Erjavec I, Gupta M, Pećin M, Bordukalo-Nikšić T, Štoković N, Vnuk D, Farkaš V, Capak H, Milošević M, Bubić Špoljar J, Perić M, Vučković M, Matičić D, Windhager R, Oppermann H, Sampath TK; Vukičević S. Autologous blood coagulum containing rhBMP6 induces new bone formation to promote anterior lumbar interbody fusion (ALIF) and posterolateral lumbar fusion (PLF) of spine in sheep. Bone 138, 2020, doi: 10.1016/j.bone.2020.115448
- Chiari C, Grgurević L, Bordukalo-Nikšić T, Oppermann H, Valentinitsch A, Nemecek E, Staats K, Schreiner M, Trost C, Kolb A, Kainberger F, Pehar S, Milošević M, Martinović S, Perić M, Sampath TK, Vukičević S, Windhager R. Recombinant HumanBMP6 applied within autologous blood coagulum accelerates bone healing: randomized controlled trial in high tibial osteotomy patients. Journal of Bone and Mineral Research 35(10):1893-1903, 2020, doi: 10.1002/jbmr.4107
- Vukičević S, Grgurević L, Erjavec I, Pećin M, Bordukalo-Nikšić T, Štoković N, Lipar M, Capak H, Matičić D, Windhager R, Sampath TK, Gupta M. Autologous blood coagulum is a physiological carrier for BMP6 to induce new bone formation and promote posterolateral lumbar spine fusion in rabbits. Journal of Tissue Engineering and Regenerative Medicine 14(1):147-159, 2020, doi: 10.1002/term.2981
- Pauk M, Bordukalo-Nikšić T, Brkljačić J, Paralkar VM, Brault AL, Dumić-Čule I, Borovečki F, Grgurević L, Vukičević S. A novel role of bone morphogenetic protein 6 (BMP6) in glucose homeostasis. Acta Diabetologica 56(3):365-371, 2019, doi: 10.1007/s00592-018-1265-1
- Dumić-Čule I, Perić M, Kučko L, Grgurević L, Pećina M, Vukičević S. Bone morphogenetic proteins in fracture repair. International Orthopaedics 42(11):2619-2626, 2018, doi: 10.1007/s00264-018-4153-y
- Vukičević S, Sampath TK (editors). Bone Morphogenetic Proteins: Systems Biology Regulators. Springer, 2017. doi: https://doi.org/10.1007/978-3-319-47507-3
- Grgurević L, Erjavec I, Grgurević I, Dumić-Čule I, Brkljačić J, Verbanac D, Matijašić M, Čipčić Paljetak H, Novak R, Plečko M, Bubić Špoljar J, Rogić D, Kufner V, Pauk M, Bordukalo-Nikšić T, Vukičević S. Systemic inhibition of BMP1-3 decreases progression of CCl4-induced liver fibrosis in rats. Growth Factors 35(6):201-215, 2017, doi: 10.1080/08977194.2018.1428966
- Erjavec I, Bordukalo-Nikšić T, Brkljačić J, Grčević D, Mokrović G, Kesić M, Rogić D, Zavadoski W, Paralkar VM, Grgurević L, Trkulja V, Čičin-Šain L, Vukičević S. Constitutively elevated blood serotonin is associated with bone loss and type 2 diabetes in rats. PloS One 11(2):e0150102, 2016, doi: 10.1371/journal.pone.0150102
- Grgurević L, Christensen GL, Schulz TJ, Vukičević S. Bone morphogenetic proteins in inflammation, glucose homeostasis and adipose tissue energy metabolism. Cytokine & Growth Factor Reviews 27:105-118, 2016, doi: 10.1016/j.cytogfr.2015.12.009
- Blažević S, Erjavec I, Brižić M, Vukičević S, Hranilović D. Molecular background and physiological consequences of altered peripheral serotonin homeostasis in adult rats perinatally treated with tranylcypromine. Journal of Physiology and Pharmacology 66(4):529-537, 2015.
- Jurišić D, Erjavec I, Trkulja V, Dumić-Čule I, Hadžibegović I, Kovačević L, Svaguša T, Stanec Z, Vukičević S, Grgurević L. Soluble type III TGF beta receptor in diagnosis and follow-up of patients with breast cancer. Growth Factors 33(3):200-209, 2015., doi: 10.3109/08977194.2015.1055740
- Dumić-Čule I, Pećina M, Jelić M, Jankolija M, Popek I, Grgurević L, Vukičević S. Biological aspects of segmental bone defects management. International Orthopaedics 39(5).1005-1011, 2015., doi: 10.1007/s00264-015-2728-4
- Perić M, Dumić-Čule I, Grčević D, Matijašić M, Verbanac D, Paul R, Grgurević L, Trkulja V, Bagi CM, Vukičević S. The rational use of animal models in the evaluation of novel bone regenerative therapies. Bone 70:73-86, 2015, doi: 10.1016/j.bone.2014.07.010
- Pauk M, Grgurević L, Brkljačić J, Kufner V, Bordukalo-Nikšić T, Grabušić K, Razdorov G, Rogić D, Žuvić M, Oppermann H, Babitt JL, Lin HY, Volarević S, Vukičević S. Exogenous BMP7 corrects plasma iron overload and bone loss in Bmp6-/- mice. International Orthopaedics 39(1):161-172, 2015. doi: 10.1007/s00264-014-2550-4
- Cvjetičanin B, Prutki M, Dumić-Čule I, Veir Z, Grgurević L, Vukičević S. Possible target for preventing fibrotic scar formation following acute myocardial infarction. Medical Hypotheses 83(6):656-658, 2014. doi:10.1016/j.mehy.2014.09.011
- Dumić-Čule I, Brkljačić J, Rogić D, Bordukalo-Nikšić T, Tikvica Luetić A, Drača N, Kufner V, Trkulja V, Grgurević L, Vukičević S. Systemically available bone morphogenetic protein two and seven affect bone metabolism. International Orthopaedics 38(9):1979-1985, 2014. doi:10.1007/s00264-014-2425-8
- Dumić-Čule I , Drača N, Tikvica Luetić A, Ježek D, Rogić D, Grgurević L, Vukičević S. TSH prevents bone resorption and with calcitriol synergistically stimulates bone formation in rats with low levels of calciotropic hormones. Hormone and Metabolic Research 46(5):305-312, 2014. doi: 10.1055/s-0033-1363989
- Vukičević S, Oppermann H, Verbanac D, Jankolija M, Popek I, Čuark J, Brkljačić J, Pauk M, Erjavec I, Francetić I, Dumić-Čule I, Jelić M, Đurđević D, Vlahović T, Novak R, Kufner V, Bordukalo-Nikšić T, Kozlović M, Banić Tomišić Z, Bubić Špoljar J, Bastalić I, Vikić Topić S, Perić M, Pećina M, Grgurević L. The clinical use of bone morphogenetic proteins revisited: a novel biocompatible carrier device OSTEOGROW for bone healing. International Orthopaedics 38(3):635-647, 2014. doi: 10.1007/s00264-013-2201-1
- Brkljačić J, Pauk M, Erjavec I, Cipčić A, Grgurević L, Zadro R, Inman GJ, Vukičević S. Exogenous heparin binds and inhibits bone morphogenetic protein 6 biological activity. International Orthopaedics 37(3):529-541, 2013. doi: 10.1007/s00264-012-1714-3
- Božić D, Grgurević L, Erjavec I, Brkljačić J, Orlić I, Razdorov G, Grgurević I, Vukičević S, Plančak D. The proteome and gene expression profile of cementoblastic cells treated by bone morphogenetic protein-7 in vitro. Journal of Clinical Periodontology 39(1):80-90, 2012. doi: 10.1111/j.1600-051X.2011.01794.x
- Grgurević L, Maček B, Merčep M, Jelić M, Smoljanović T, Erjavec I, Dumić-Čule I, Prgomet S, Đurđević D, Vnuk D, Lipar M, Stejskal M, Kufner V, Brkljačić J, Matičić D, Vukičević S. Bone morphogenetic protein (BMP)1-3 enhances bone repair. Biochemical and Biophysical Research Communications 408(1):25-31, 2011. doi: 10.1016/j.bbrc.2011.03.109
- Grgurević L, Maček B, Healy DR, Brault AL, Erjavec I, Cipčić A, Grgurević I, Rogić D, Galešić K, Brkljačić J, Stern-Padovan R, Parlkar V, Vukičević S. Circulating Bone Morphogenetic Protein 1-3 isoform increases renal fibrosis. Journal of the American Society of Nephrology 22(4):681-692, 2011. doi: 10.1681/ASN.2010070722
Suradničke institucije
Klinički bolnički centar "Zagreb"
Klinički bolnički centar "Sestre milosrdnice"
Klinička bolnica "Dubrava"
Klinička bolnica "Merkur"
Klinika za dječje bolesti "Zagreb"
Klinika za tumore - Klinički bolnički centar "Sestre milosrdnice"
PMF - Kemijski odsjek, Sveučilište u Zagrebu
Veterinarski fakultet Sveučilišta u Zagrebu
Stomatološki fakultet Sveučilišta u Zagrebu
Institut Ruđer Bošković
privatne poliklinike
Znanstvena oprema na raspolaganju po Odjelima.
prof. dr. sc. Fran Borovečki
+385 1 45 90 068
fran.borovecki@mef.hr